生きたマウスの腫瘍血管内皮細胞におけるシグナル分子活性の可視化に成功
〜腫瘍血管内皮のPKAはVEGFR依存的な腫瘍血管透過性を負に制御す〜
血管透過性の制御に関わるプロテインキナーゼA(PKA)の酵素活性を、生きたマウスの腫瘍血管内皮細胞で観察することに世界で初めて成功しました。さらに、この観察の結果より、(1)腫瘍血管内皮のPKA活性は正常血管内皮に比べて低いこと、(2)腫瘍内皮細胞のPKAを活性化させることで、腫瘍血管透過性が減少すること、(3)血管透過性制御に重要な血管内皮成長因子(VEGF)とその受容体(VEGFR)経路において、内皮PKAは負の制御因子であることが分かりました。また大変興味深いことに、培養ヒト内皮細胞と生きたマウス内では、VEGFによる内皮PKAの活性化応答が異なることがわかりました。生きたマウスを用いたイメージング研究は、疾病の分子メカニズムを理解するための有効なアプローチと思われます。本研究成果は米国科学雑誌「Cancer Research(キャンサーリサーチ)」に発表されました。 (こちら)。
研究の背景
腫瘍の病理学的特徴の一つである血管透過性亢進は、血管新生や転移と関係するため、その分子メカニズムを理解することが重要です。血管透過性の関連分子であるVEGFは、VEGFRを介して血管内皮細胞に作用し、血管透過性を増加させています。他にも多くの関連分子が存在しますが、cAMPもその一つです。cAMPは血管内皮細胞のPKAやEpacを活性化させ、内皮バリア機能を強化する作用によって、血管透過性を抑える方向に働くことがわかっています。しかし、これら分子の研究は、これまでは培養細胞を用いており、生きた個体の腫瘍血管では調べられていませんでした。 私たちの研究室では、蛍光共鳴エネルギー移動(FRET)の原理に基づくバイオセンサーを発現するトランスジェニックマウス(FRETマウス)を作製し、二光子励起顕微鏡により、様々な組織で分子活性を可視化してきました。 そこで本研究では、腫瘍組織の血管透過性の分子メカニズム解明のために、FRETマウスを用いて、生体内での腫瘍血管内皮細胞のPKA活性と血管透過性の関連を調べました。
研究の内容と成果
FRETマウスとして、PKA活性を観察できるPKAchuマウスと細胞外シグナル制御キナーゼ(Extracellular signal-regulated kinase, ERK)活性を観察できるEISUKEマウスを用いました。これらのFRETマウスの皮下に癌細胞を移植し、担ガンマウスを調製しました。麻酔下の担ガンマウスの腫瘍組織を露出させ、二光子励起顕微鏡にて腫瘍組織の血管内皮細胞を可視化することに成功しました(図1)。
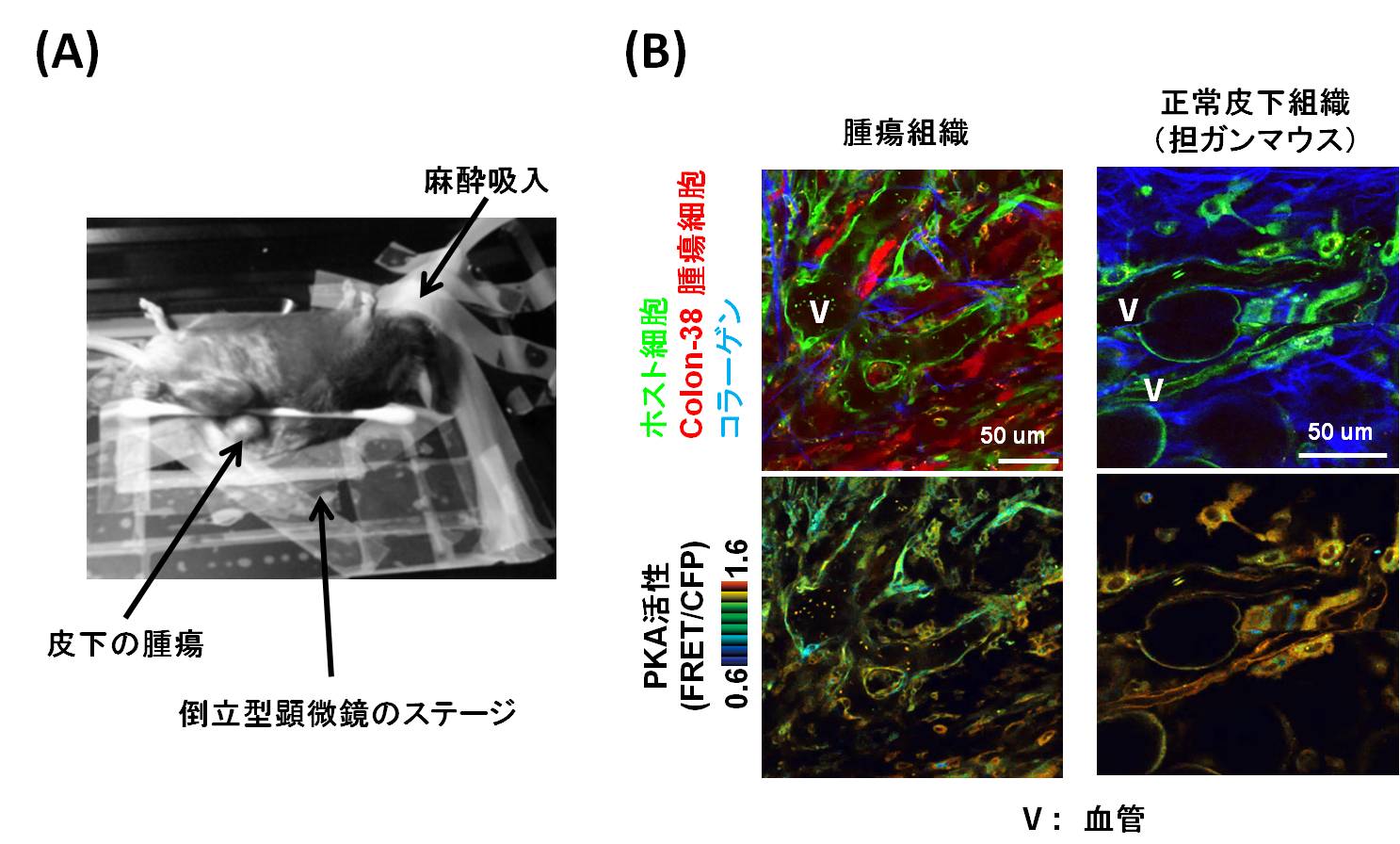
図1: 腫瘍血管内皮細胞の可視化。(A)顕微鏡ステージ上の担ガンマウスの写真。皮下の腫瘍を露出させてカバーガラス上に固定する。(B)腫瘍組織と正常皮下組織の蛍光画像とFRET画像。上段画像は蛍光画像で、赤が腫瘍細胞(colon38)、緑がFRETマウス由来のホスト細胞、青はコラーゲン線維。正常皮下組織では多くのコラーゲン線維に囲まれた毛細血管が観察できる。下段は、対応した腫瘍組織と正常皮下組織のFRET画像であり、PKA活性を示す。PKA活性はヒートマップ表示であり、赤が高活性、青が低活性を意味する。
最初に、腫瘍血管内皮細胞と正常血管内皮細胞(皮下組織の毛細血管)について、PKAとERKのベーサル活性を観察しました。その結果、腫瘍血管内皮のPKA活性は正常血管内皮に比べて低いことがわかりました。一方、両者のERK活性には差が見られませんでした(図2)。
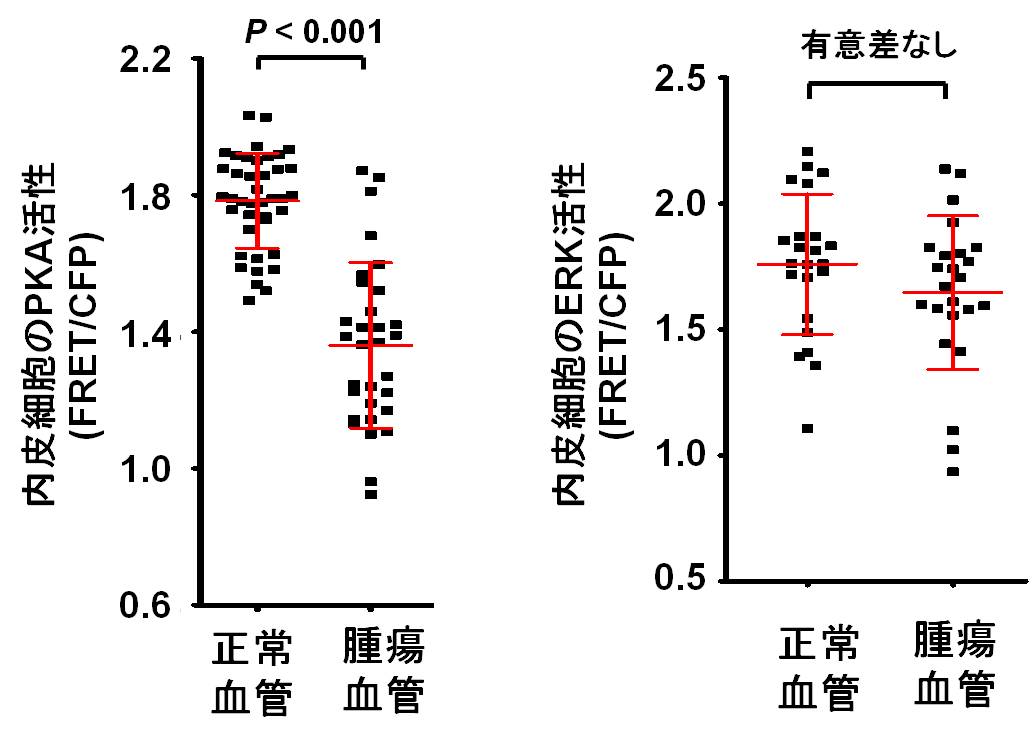
図2: 腫瘍血管内皮と正常血管内皮のPKA活性とERK活性の比較結果。PKA活性は腫瘍血管内皮が正常に比べて低かった。 ERK活性は差が見られなかった。
次に、腫瘍内皮細胞の低いPKA活性と血管透過性の関係を調べるために、腫瘍と皮膚の血管透過性におけるcAMP類似体(dbcAMP)の影響を調べました。その結果、図3に示すように、皮膚に比べて、腫瘍は高い血管透過性を示しましたが、dbcAMPを投与した担癌マウスでは、腫瘍の血管透過性が低下しました(PBS投与群との比較)。同時に、FRETイメージング解析によって、dbcAMPによる腫瘍内皮細胞のPKA活性化が認められたことから、低いPKA活性は腫瘍の高い血管透過性に関与していることが示唆されました。
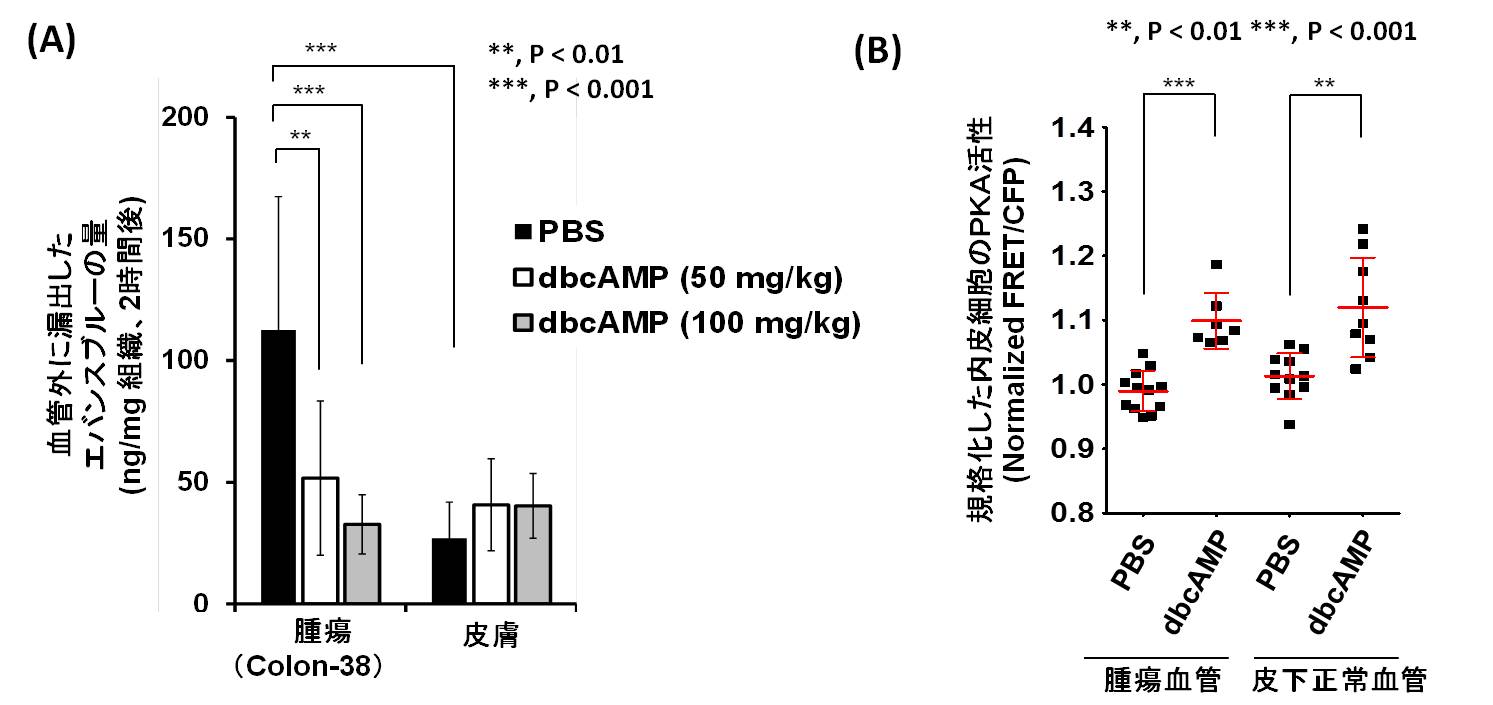
図3: dbcAMPによる腫瘍血管透過性の減少と内皮PKA活性の関係。(A) 組織の血管透過性は、マイルスアッセイにより測定した。PBS対照群に比較して、dbcAMP投与マウスでは、腫瘍組織の血管透過性が減少した。(B)生体内FRETイメージング解析によるPKA活性の変化。PBSあるいはdbcAMP投与 (50 mg/kg)後、16分目のデータ(投与前のFRET/CFPで規格化)。
次に、血管透過性制御に関わるVEGFR経路とPKA活性の関係を調べました。VEGFR阻害剤であるMotesanibを担癌マウスに投与した結果、腫瘍の血管透過性が低下しました(図4)。生体内FRETイメージングと免疫染色解析により、Motesanibは腫瘍内皮細胞のPKAを活性化すること、またVEGFR2リン酸化活性を低下させることがわかりました。これらの結果より、VEGFR活性の抑制がPKAの活性化につながり、その結果、血管透過性が低下したと考えられました。
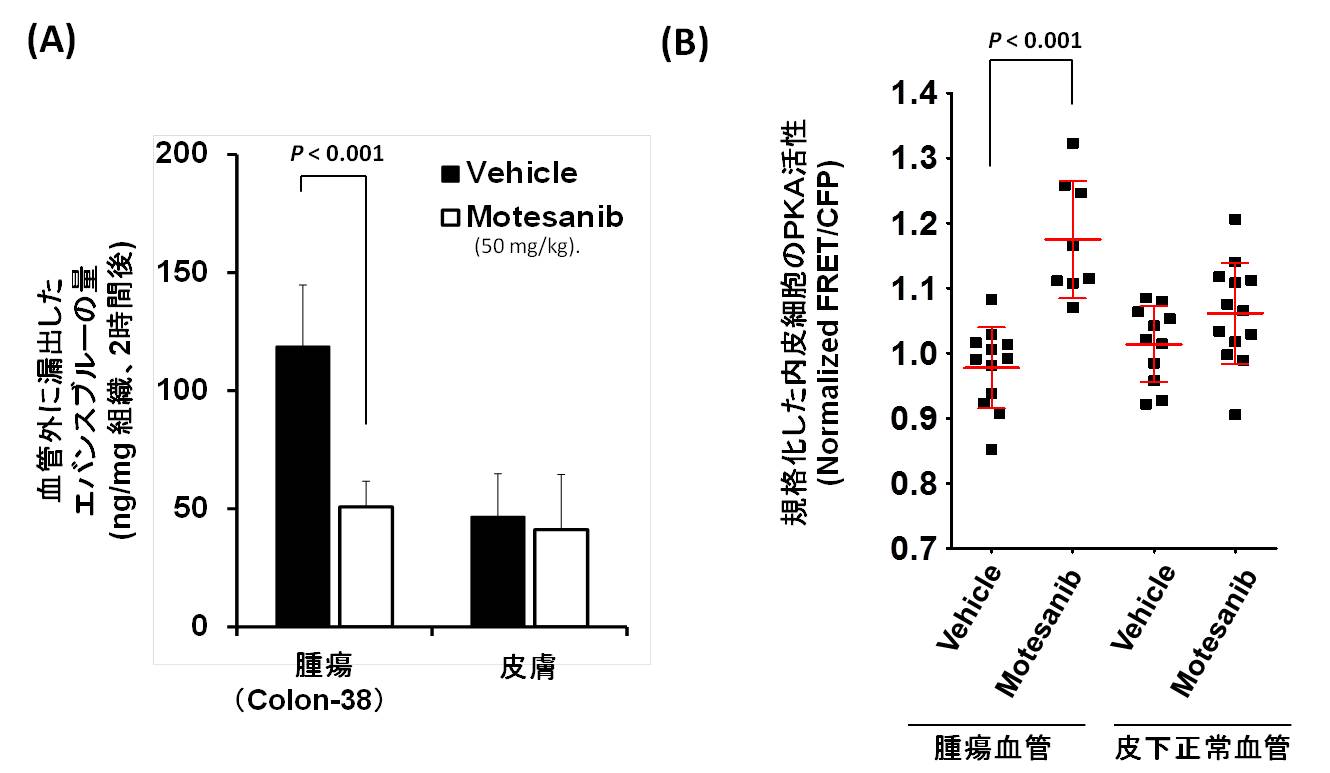
図4: Motesanibによる腫瘍血管透過性の減少と内皮PKA活性の関係。(A) PBS対照群に比較して、Motesanib投与マウスでは、腫瘍組織の血管透過性が減少した。(B)生体内FRETイメージング解析によるPKA活性の変化。PBSあるいはMotesanib投与 (50 mg/kg)後、26分目のデータ(投与前のFRET/CFPで規格化)。
この仮説をさらに検証するため、VEGFを皮下に注射して内皮PKA活性と血管透過性を評価した結果、VEGFによる皮下の血管透過性亢進部において、PKA活性の低下が認められました(図5)。これらの結果より、VEGFR依存的な血管透過性の亢進メカニズムには、PKAの活性低下が少なくとも関与しているものと考えられます。最後に、生体内と培養細胞の比較のために、PKAバイオセンサーを発現させたヒト臍帯血管内皮細胞(HUVEC)を用い、VEGFに対するPKA活性の応答を観察しました。大変興味深い事に、HUVECにおいてVEGFはPKAを活性化させることが分かり、生体内の結果(図5)とは一致しませんでした。この結果より、少なくとも内皮細胞におけるVEGFとPKA活性の関連については、環境の違いが影響するため、生体内で解析する重要性が示されたと思われます。
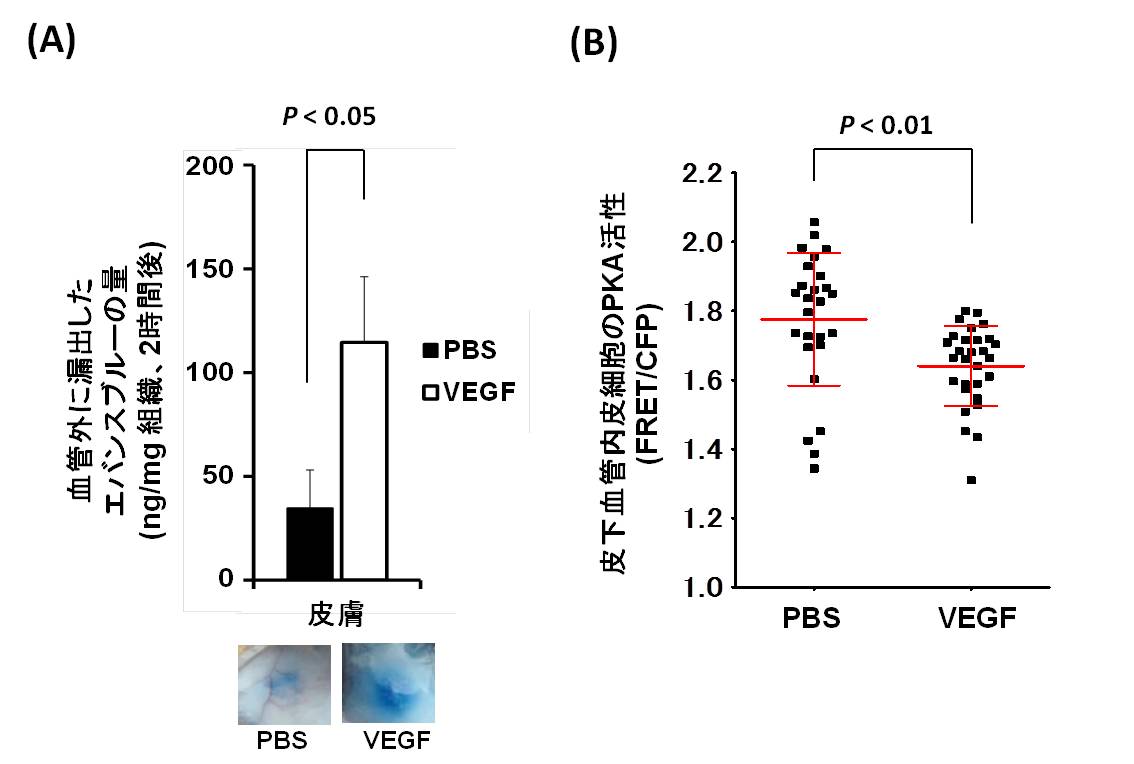
図5:VEGFによる皮下の血管透過性の増加と内皮PKA活性の関係。(A) PBS対照群に比較して、VEGF投与部では、皮下の血管透過性が増加した。グラフ下は皮膚組織におけるエバンスブルー漏出を示す写真。(B)生体内FRETイメージング解析による皮下血管内皮細胞のPKA活性の変化。PBSあるいはVEGF投与後、30分目のデータ。
研究の意義
腫瘍ではVEGFが多量に生産されており、血管透過性が亢進していることがわかっています。私たちの研究結果は、その分子メカニズムの少なくともひとつは、血管内皮PKAの活性低下を伴っていることを示唆するものです。よって、PKAを活性化する薬剤によって、腫瘍の血管透過性を低減させ、腫瘍の成長や転移の抑制が可能になるかもしれません。 本研究で示されたように、生体内と培養細胞の環境は異なるため、疾病の分子メカニズムを理解するためには、両者のメリットとデメリットを考慮した研究アプローチが重要になってくると思われます。FRETマウスを用いた生体内イメージングは、生体内での分子活性をリアルタイムに定量することが出来ます。抗血管新生剤など、腫瘍血管をターゲットにする薬剤の効果判断など、臨床的に有用な知見を得るためにも役立ちます。
今後の展開
今回、腫瘍血管内皮のPKA活性が低いことがわかりましたが、そのメカニズムはわかっていません。cAMPやPKAに関連する分子(GPCRなど)の発現や活性などを細かく調べる事で、PKA活性を抑えている原因が分かる可能性があります。その原因の解明により、腫瘍内皮PKAをターゲットにした合理的な抗癌剤開発などに展開できると考えられます。腫瘍内皮のPKA活性と血管新生、腫瘍成長ならびに転移との関連を調べることも、今後の課題です。