長波長蛍光タンパク質を用いたFRETバイオセンサー (Booster)の開発
〜FRETバイオセンサーと光遺伝学ツールの併用を可能に〜
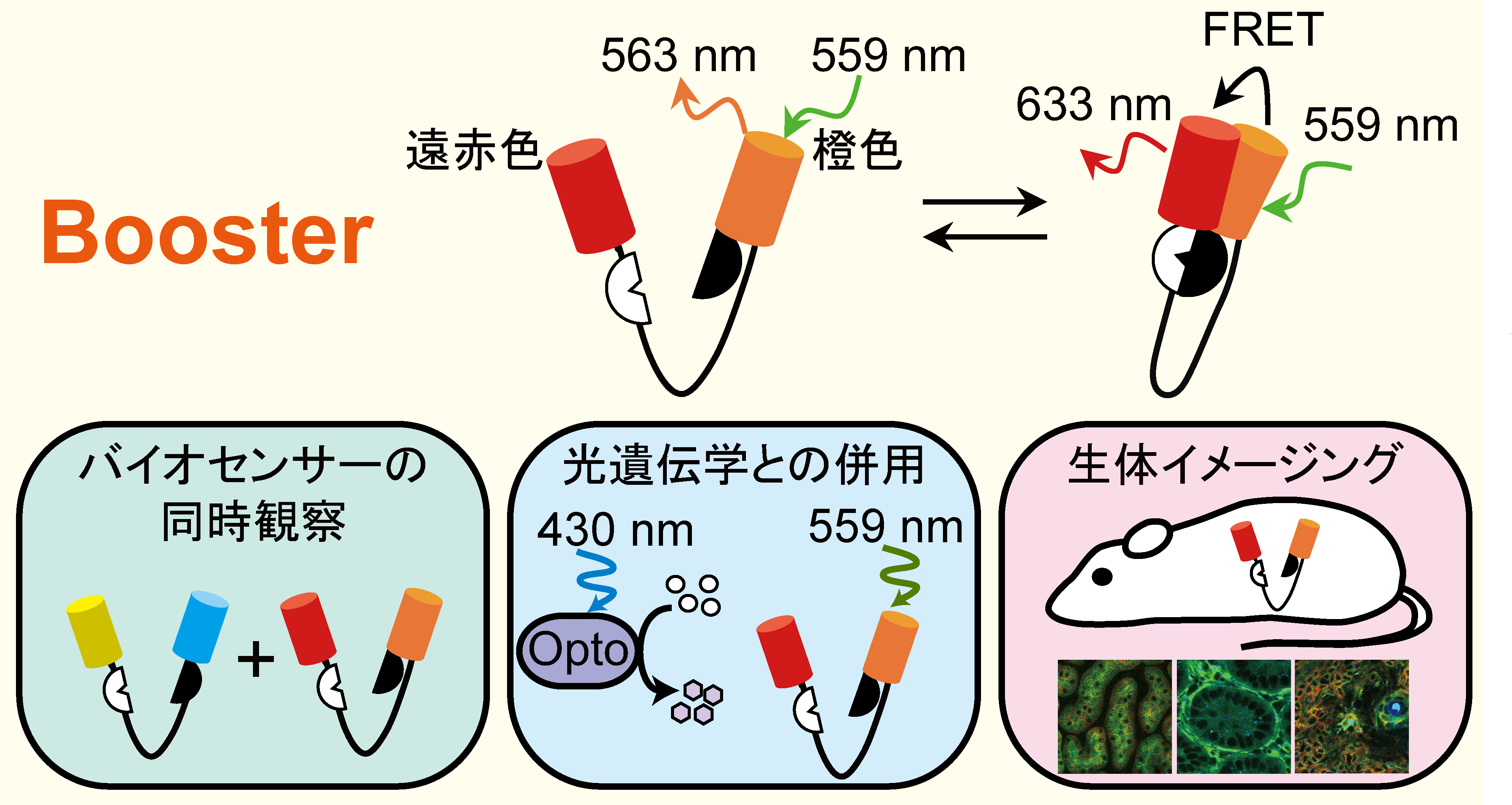
本研究では、橙・遠赤色蛍光タンパク質を用いたFRETバイオセンサー (Booster) を開発しました。従来のFRETバイオセンサーとの大きな違いは、下記の3つです。
- 橙色蛍光タンパク質にmKOκ、遠赤色蛍光タンパク質にmKate2を用いたこと。
- 各ドメインの順序を変えたこと。
- リンカーの長さを従来のおよそ倍にしたこと。
従来のシアン・黄色蛍光タンパク質 (CFP/YFP) を用いたFRETバイオセンサーと比較して、同等の蛍光強度比および蛍光寿命の変化を示すFRETバイオセンサー開発に成功し、これをBoosterと名付けました。励起、および観察波長が長波長になったため、CFP/YFPを用いたFRETバイオセンサーとBoosterの同時観察や、青色光依存性の光遺伝学ツールとBoosterの併用が可能となりました。さらに、プロテインキナーゼA (PKA) の活性を反映するBooster (Booster-PKA) を全身発現するマウス (Booster-PKAchu) の作出にも成功し、生きたマウスでPKA活性の測定を実現しました。
本研究成果は、2020年2月26日に米国の国際学術誌「ACS sensors」にオンライン掲載されました。
(こちら)。
研究の背景
生細胞内におけるシグナル伝達の理解に向けて、シグナル伝達分子の活性をモニターするFRETバイオセンサーや、分子活性に摂動を与える光遺伝学ツールが多数開発されています。従来のFRETバイオセンサーの多くはシアン・黄色蛍光タンパク質 (CFP/YFP) を用いており、励起光に青色光を使用します。他方、摂動を与える目的で用いられる光遺伝学ツールは、チャネルロドプシンやクリプトクロム2 (CRY2)、LOVドメインとなどからなり、青色光で活性化されます。従って、FRETバイオセンサーの観察による青色光が、光遺伝学ツールを活性化させてしまう、【観察と摂動が分離できない】という問題点がありました。
研究の内容と成果
|
FRETバイオセンサーで用いる蛍光タンパク質を長波長化することで、【観察と摂動が分離できない】問題点の解決を目指し、本研究を行いました。長波長のFRETバイオセンサーの開発には、1) 蛍光タンパク質の選定 2) 各ドメインの順序の決定 3) リンカー長の延長 の3つの段階を経ました (図1) 。 1) 蛍光タンパク質の選定 遠赤色蛍光タンパク質のmKate2と、橙色蛍光タンパク質のmKOκを選びました。mKate2は遠赤色蛍光タンパク質の中で最も量子収率が高く、ドナーから受け取ったエネルギーを高効率に光に変換することが期待できます。mKate2をアクセプターとしたときに、最もFRETを起こしやすいドナー蛍光タンパク質をフェルスター距離から求め、mKOκを選定しました。 2) 各ドメインの順序の決定 従来のPKAバイオセンサー (AKAR3EV) の蛍光タンパク質をmKOκ、mKate2に置換しましたが、AKAR3EVに比して半分程度しかFRET効率の変化が認められませんでした。更なる改善を目指して、各ドメイン (各蛍光タンパク質とリガンドドメイン、センサードメイン) の順序を入れ替えた16通りを作成し、N末からmKate2, リガンドドメイン、mKOκ、センサードメインの順序で最もFRET効率の変化が大きいことを突き止めました。 3) リンカー長の延長 刺激前のFRET効率の低下させるため、リンカーの長さを116アミノ酸から244アミノ酸に延長しました。これにより、FRET効率の変化量が約1.2 倍大きくなりました。 以上の改良により、従来のCFP/YFPを用いたAKAR3EVと同等の性能を持つPKAバイオセンサーの作成に成功し、Booster-PKAと名付けました。 Booster-PKAにより、光遺伝学ツールの一つであるbPACとの併用 (図2) 、CFP/YFPを用いた従来型のバイオセンサーとの同時観察(図3)が可能となりました。また、PKA以外にも、ERKやJNK、ROCK活性を反映するBooster-ERK、-JNK、ROCKの開発にも成功しました。さらに、Booster-PKAを全身発現するトランスジェニックマウス (Booster-PKAchu) を作出し、生体組織でPKA活性測定が出来ることを確認しました (図4) 。 |
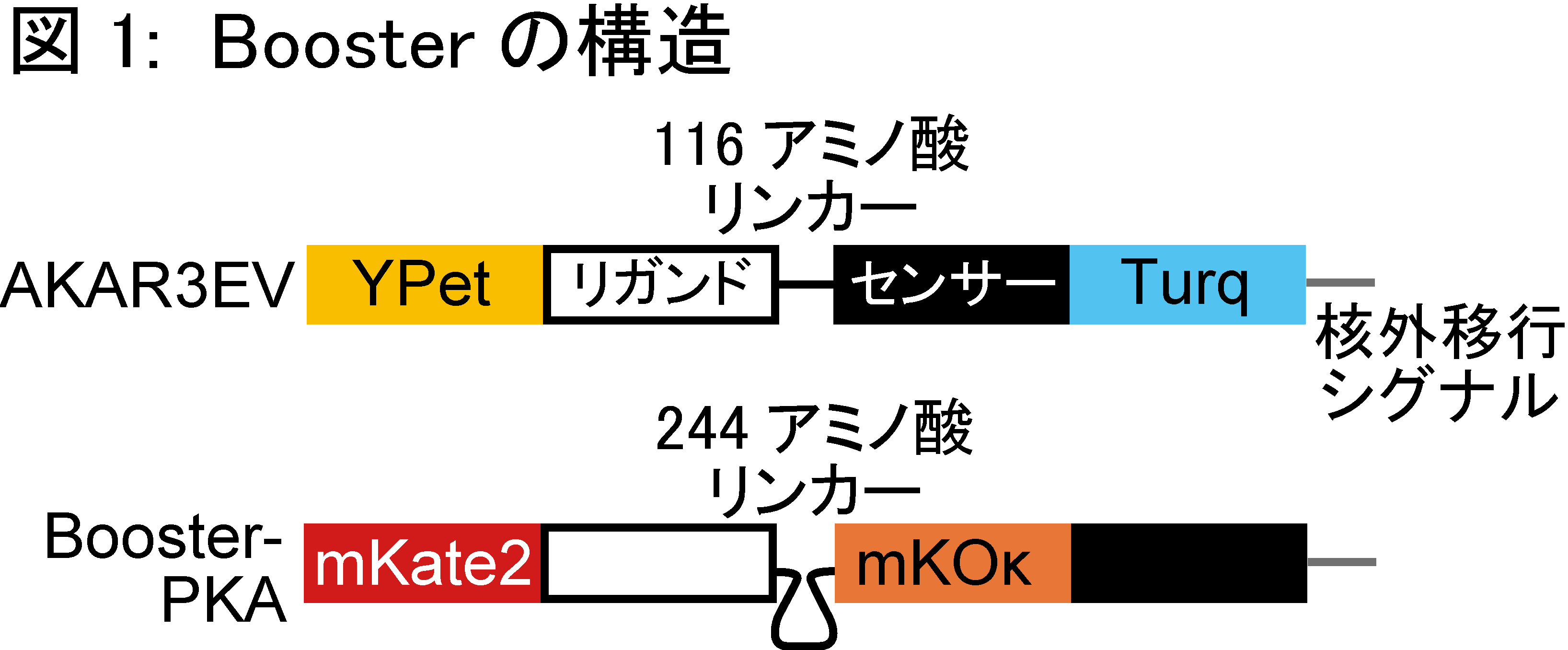
図1: Boosterの構造 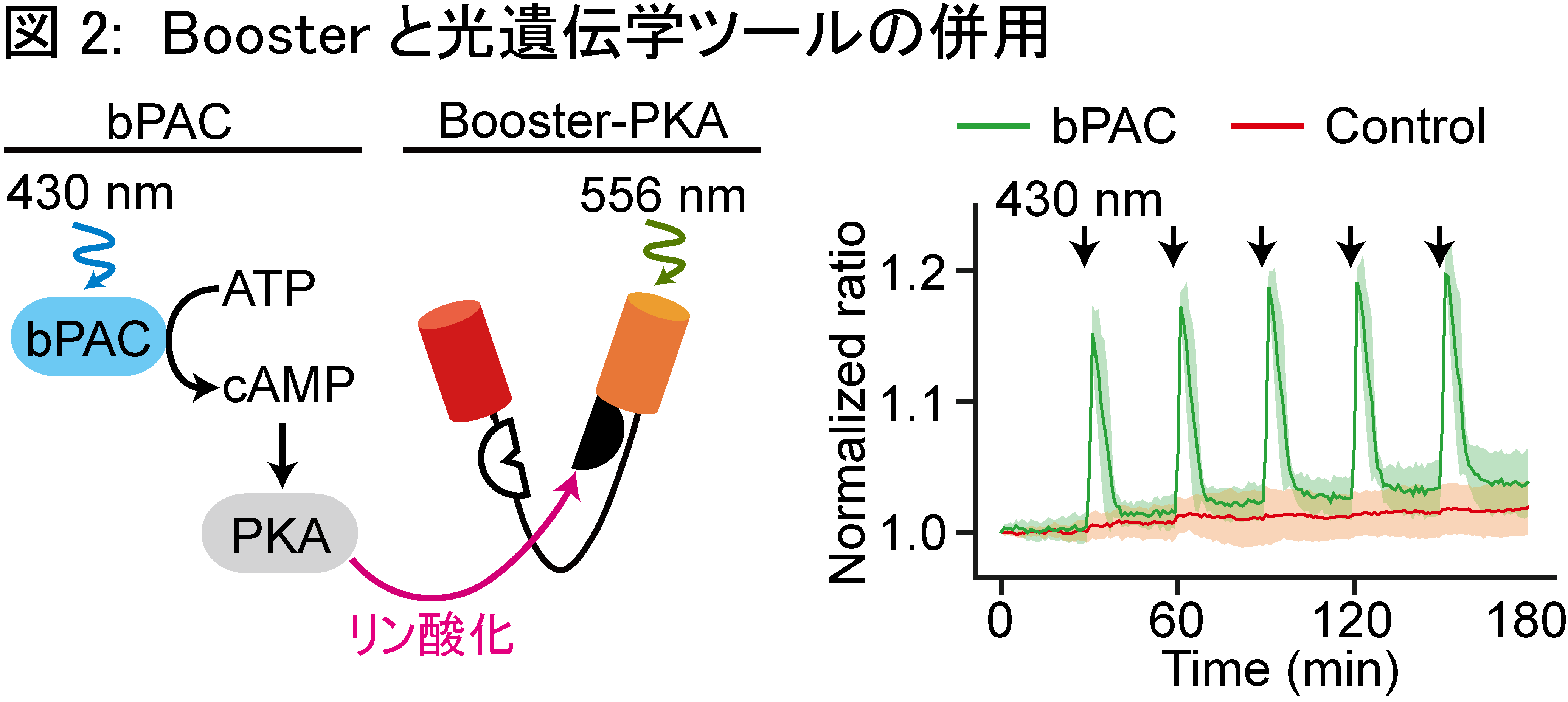
図2: Boosterと光遺伝学ツールの併用 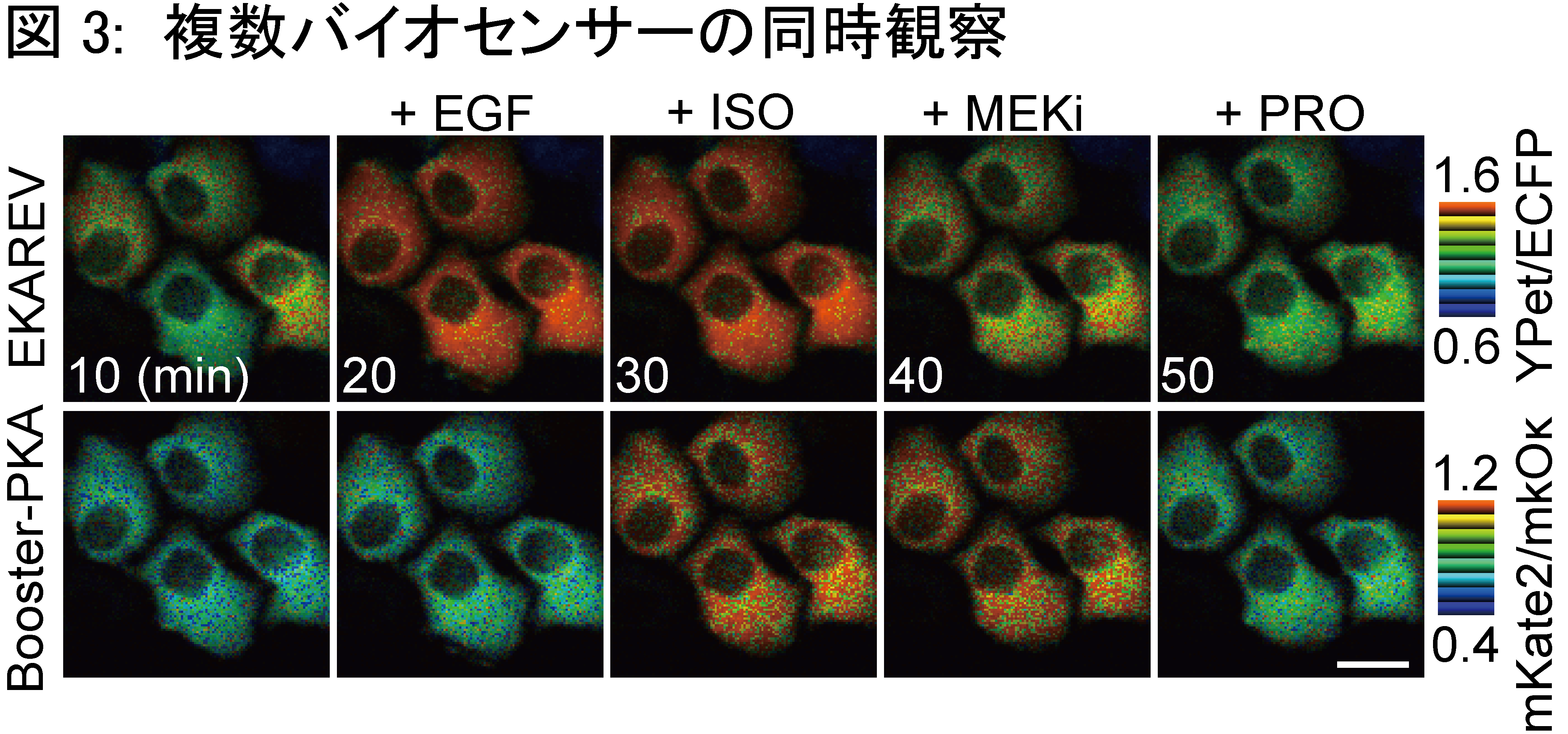
図3: 複数バイオセンサーの同時観察 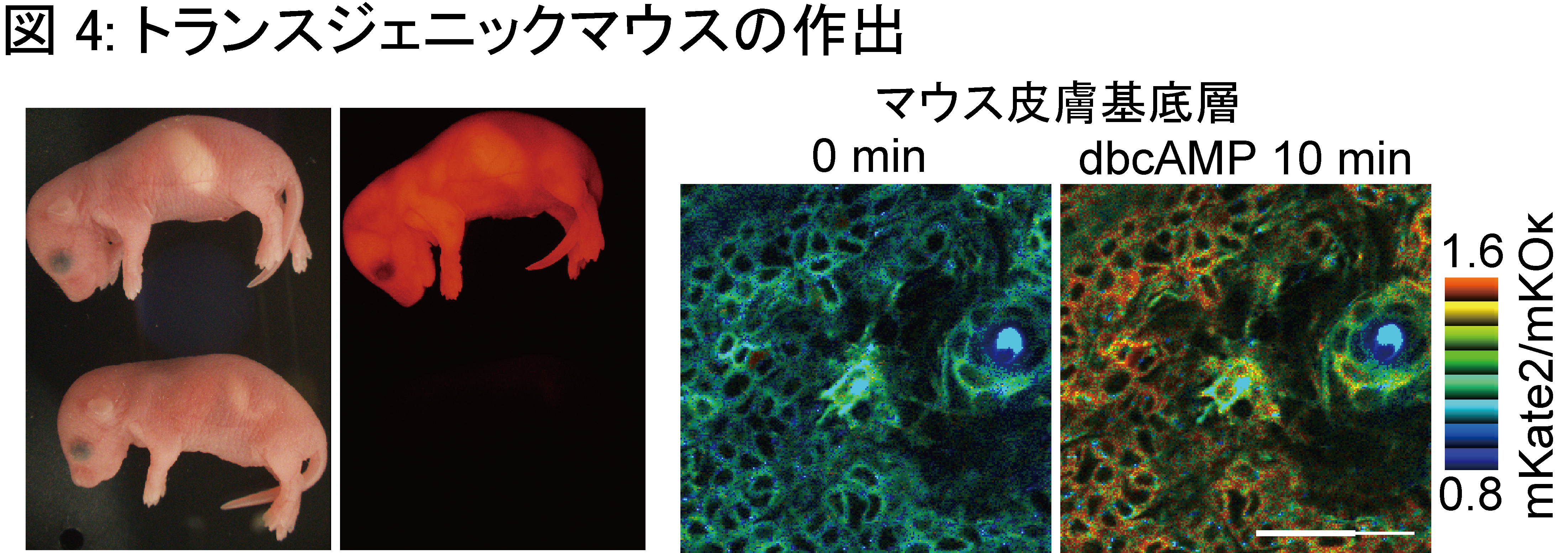
図4: トランスジェニックマウスの作出 |
研究の意義
本研究により、シグナルの観察と摂動を分離して行うことが出来るようになりました。 従来の光遺伝学による摂動実験では、表現型や行動分析によって定性的な結果を捉えていました。摂動を与えた分子の活性化を同時にモニターすることにより、【定量的な摂動】を与えることが可能となり、分子活性の強弱と表現型との関係を理解する事につながります。
今後の展開
現在、Boosterと光遺伝学を併用して、分子活性の細胞間制御機構の解明を進めています。光遺伝学を用いてシグナル強度を制御しつつ、同時にその応答を観察することで、従来では難しかった単一細胞レベルでのシグナル伝達の解明を目指しています。
用語解説
FRETバイオセンサー: 近接した2個の蛍光分子の間でエネルギーが移動する現象 (FRET) を応用し、分子間距離や分子内構造変化を蛍光強度変化に変換し、細胞内シグナル伝達を可視化するセンサー。
光遺伝学ツール: 植物や細菌由来の光活性化タンパク質、およびその改変体。神経細胞を始めとする様々な細胞のシグナル活性を制御し、生体機能を操作する。
量子収率: 蛍光分子が1つの光子を吸収した際に、蛍光として光子が放出される確率。
フェルスター距離: エネルギー移動効率が50%となるドナーとアクセプター間の距離。
bPAC: 細菌由来の光活性化アデニル酸シクラーゼ合成酵素。
研究プロジェクトについて
日本学術振興会科学研究費助成事業、科学技術振興機構戦略的創造研究推進事業(CREST) の支援を受け、実施しました。