TAK1活性を検出する新規FRETバイオセンサーの開発
〜生きたマウス体内で増殖する腫瘍内のTAK1活性を可視化〜
様々なストレスにより活性化するTGF-β activated kinase 1 (TAK1) というリン酸化酵素の活性をモニターする新規FRETバイオセンサーを開発しました。本バイオセンサーを発現する3LL細胞をwindow下に移植し腫瘍を形成させ、二光子励起顕微鏡を用いて数日間にわたり観察を行いました。すると、腫瘍塊の中心部から辺縁領域にかけてTAK1活性が高くなっていることを発見しました。さらにpolyI:Cを投与すると腫瘍塊内で一様にTAK1活性化が見られました。本研究成果は科学雑誌「Cancer Science」に掲載され、表紙を飾りました。 (こちら)。
研究の背景
TAK1は炎症や免疫応答、細胞死を制御する因子として重要な役割を担っていることがわかっています。しかしこれまでTAK1活性を生きた細胞・組織内でリアルタイムに可視化することは困難でした。私たちの研究室では、様々なタンパク質リン酸化酵素活性を生きた細胞内でリアルタイムにモニターするため、蛍光共鳴エネルギー移動 (FRET) の原理に基づくバイオセンサーを開発してきました。またそうしたFRETバイオセンサーを培養細胞だけでなく生きたマウスを使って二光子励起顕微鏡で観察するin vivo imagingに応用することで、生体内での現象や細胞間コミュニケーションを解明することを目指しています。本研究ではFRETバイオセンサーを用いてTAK1活性の可視化を試み、そして生きたマウス体内で増殖する腫瘍の観察に応用しました。
研究の内容と成果
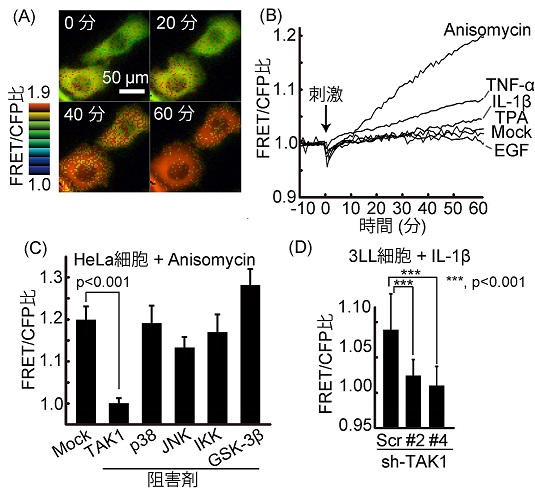
まずTAK1活性を生きた細胞内でリアルタイムに検出するため、蛍光共鳴エネルギー移動 (FRET) に基づく新規バイオセンサーを開発しました。FRET/CFP比が大きいほどTAK1活性が高く、小さいほどTAK1活性が低いことを示しており、ヒートマップ表示ではそれぞれ赤色、青色で表せます。本バイオセンサーを培養細胞に発現させて様々な刺激に対する応答性を確認しました。次にこのバイオセンサーのTAK1特異性を調べました。TAK1阻害剤、shRNAを用いたTAK1ノックダウンでは本バイオセンサーのFRET/CFP比の上昇が抑制されることを確認しました(図1)。私たちは本バイオセンサーをEevee-TAK1と命名しました。
図1:Eevee-TAK1の応答性、特異性の確認。(A) HeLa細胞にEevee-TAK1を発現させ、5μg/mL anisomycin刺激を加えた後、60分間にわたって細胞内でのFRET/CFP比の変化を観察した。(B) HeLa細胞にEevee-TAK1を発現させ、様々な刺激に対する応答性を確認した。(C) HeLa細胞にEevee-TAK1を発現させ、様々なリン酸化酵素の阻害剤を加えることでanisomycin刺激後のFRET/CFP比上昇が抑制されるかどうか確認した。(D) 3LL細胞にEevee-TAK1を発現させ、さらにshRNAを用いてTAK1をノックダウンして、IL-1β刺激後のFRET/CFP比上昇が抑制されるかどうか確認した。
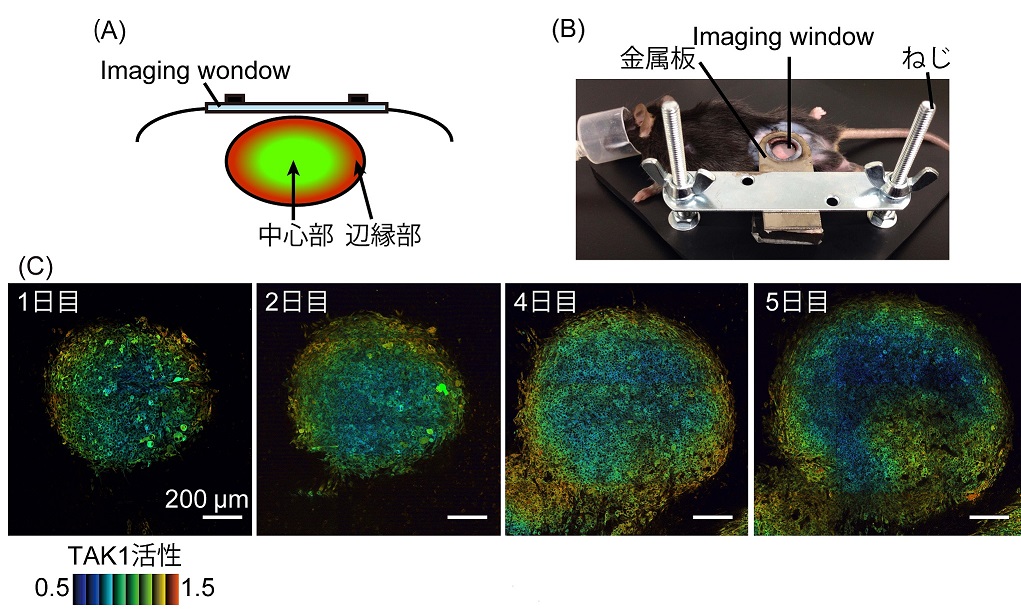
次に、Eevee-TAK1をマウスを用いたin vivo imagingに応用し、マウス皮下に移植した腫瘍内でのTAK1活性を観察しました。ガラスと磁石で作成したimaging windowを使って、マウス皮下に移植した腫瘍を二光子励起顕微鏡で数日にわたって観察できる実験系を確立しました。Imaging window下に3LL細胞を移植したところ、腫瘍の中心部から辺縁部にかけてTAK1活性が高くなっていることが分かりました(図2)。
図2:(A) Imaging windowと移植した腫瘍のイメージ図。(B) マウスの固定方法。(C) 二光子励起顕微鏡を用いて5日間にわたってimaging window下の腫瘍を観察した。
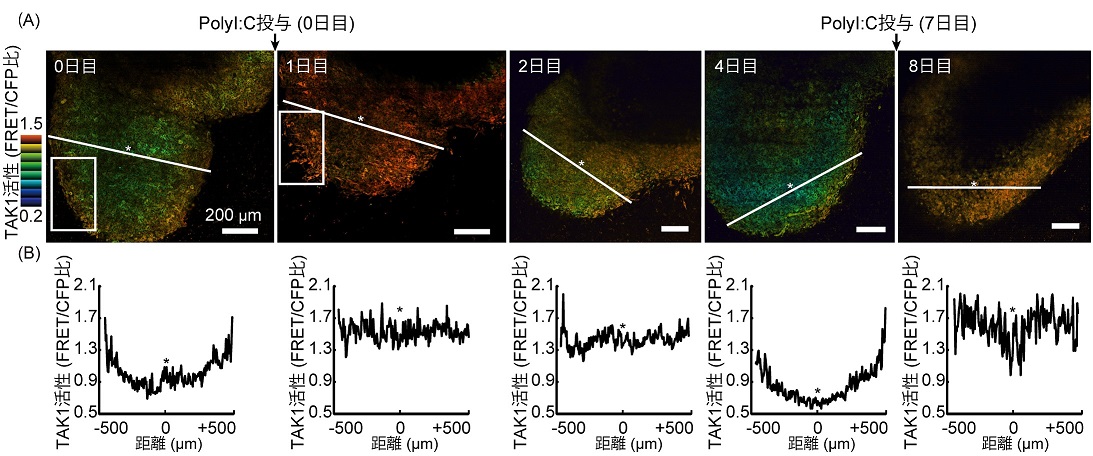
さらに、先行研究においてPolyI:C投与により腫瘍が小さくなることが知られていましたが、その時に腫瘍塊内のTAK1活性がどのように変化するかを調べました。すると、腫瘍塊内でTAK1活性が一様に上昇する様子を観察することに成功しました(図3)。
図3:(A) Imaging window下にpolyI:Cを投与し、腫瘍内におけるTAK1活性の変化を観察した。(B) 横軸に(A)中の*を原点とした直線上の距離、縦軸に直線上のFRET/CFP比をプロットした。
研究の意義
世界で初めて、FRETを利用してTAK1活性を生きた細胞内でリアルタイムにモニターする技術を開発しました。さらに一つの腫瘍塊内でTAK1が部位により異なることを初めて発見しました。このようにFRETバイオセンサーと二光子励起顕微鏡を用いたin vivo imagingの技術を組み合わせることにより、生きた組織内でのシグナル伝達の研究がさらに発展することが期待されます。
今後の展開
TAK1は炎症や免疫応答だけでなく、様々なストレス誘因性の刺激で活性化されることがわかっていることから、Eevee-TAK1はストレスセンサーとして応用できる可能性があります。私たちは本研究をさらに進展させるべく、Eevee-TAK1を全身で発現する遺伝子改変マウスを作成し解析を行っています。