蛍光と発光のハイブリット型バイオセンサー
〜ワンステップで蛍光バイオセンサーを発光モードに〜
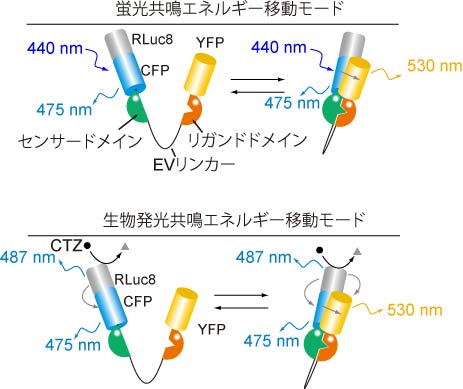
図1: hyBRETバイオセンサーの二つの作動原理
本研究では、当研究室で開発してきた多くの蛍光共鳴エネルギー移動(FRET)バイオセンサーを簡単に発光バイオセンサーに改変する技術を開発 しました。このバイオセンサーでは、ウミシイタケの発光タンパク質であるレニラルシフェラーゼをFRETバイオセンサーのシアン蛍光タンパク質に 融合することで、レニラルシフェラーゼの発光エネルギーをFRETバイオセンサー内のシアン蛍光タンパク質を励起することに用いています。 これにより、青色光を照射すれば蛍光共鳴エネルギー移動型バイオセンサーとして、ルシフェラーゼの基質であるセレンテラジンを添加すれば 生物発光共鳴エネルギー移動型バイオセンサーとして使うことができるハイブリット型バイオセンサーの開発に成功しました(図1)。 本成果は、2018年6月5日に国際学術誌「Scientific Reports」にオンライン掲載されました。 本研究成果は科学雑誌「Scientific Reports」に掲載されました。 (こちら)
研究の背景
私たちの研究室では2001年より数多くのFRETバイオセンサーを発表してきました。 これらは低分子量GTP結合タンパク質を始めとする多くの細胞内情報伝達分子の活性を生きた細胞、生きた動物で可視化するツールとして、 これまでに知ることのできなかった細胞内情報伝達系の動態解明に役立ってきました。一方、それら細胞内情報伝達分子を標的とする 薬剤スクリーニング系への応用も当初より期待されていましたが、実用には至っていませんでした。その原因のひとつは、 多くの低分子化合物が蛍光を有しているため、FRETバイオセンサーの蛍光と競合してしまい、分子活性を定量できないという欠点です。 一方、生物発光共鳴(BRET)バイオセンサーは、 薬剤スクリーニングには適しているものの発光量が少なく、細胞イメージングには適していません。
研究の内容と成果
上記の問題を解決するために、FRETでもBRETでも使えるバイオセンサーの開発を着手しました。
共同研究をしている阪大の永井教授、東大の岡田教授らはレニラルシフェラーゼを蛍光タンパク質に融合する技術を開発していました。
本研究では、その技術を使い、レニラルシフェラーゼとシアン色蛍光タンパク質融合タンパク質をFRETバイオセンサーのドナーにすることで、
ハイブリット型バイオセンサーの開発に成功し、これをhyBRETバイオセンサーと命名しました。
このバイオセンサーは、青色光で励起した場合も、発光基質セレンテラジンを添加した場合もほぼ同様の感度を有します(図2)。
そして、このhyBRETバイオセンサーを安定発現した細胞株を用いますと、薬剤効果が感度よく検出できます(図3)。
さらに、このバイオセンサーを発現する細胞株をマウスに接種し、
発光基質を静脈内注射しますと、腫瘍が検出されると同時に腫瘍内での分子活性が測定できます(図4)。
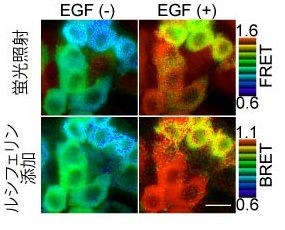
図2: FRETおよびBRETモードによる分子活性測定
ERKマップキナーゼの活性を測定するhyBRETバイオセンサーをHeLa細胞に発現させ、蛍光顕微鏡にて観察した。
観察開始直前に発光基質セレンテラジンを添加し、蛍光と発光の双方を検出することで、分子活性をFRETおよびBRETの値で定量化した。
途中で、上皮細胞増殖因子(EGF)を加え、ERK活性をの上昇を観察した。
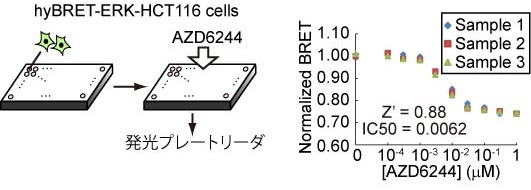
図3:hyBRETバイオセンサーを用いた薬剤スクリーニング系
ヒト大腸癌由来HCT116にERKのhyBRETバイオセンサーを発現させたものを樹立した。
MEK阻害剤を階段希釈したものを添加し、ERKに対する影響を観察した。
BRET検出は発光プレートリーダーで行った。
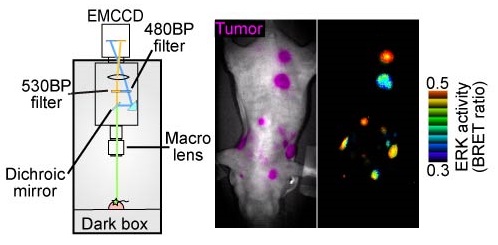
図4:マウス皮下担癌におけるERK活性の検出
4T1 マウス乳癌細胞にERKのhyBRETバイオセンサーを発現させ、皮下担癌を行った。
セレンテラジンを静注し、BRETにより癌におけるERK活性を検出した。
研究の意義
これまで研究目的に限定されてきたFRETバイオセンサーを使って薬剤スクリーニングが行われることが期待されます。 また、顕微鏡を使ったミクロのスケールから、マウス個体レベルのマクロのスケールまで、シームレスに分子活性を測定できることから 、さまざまな分子活性の多次元解析に有用と考えられます。
今後の展開
hyBRETバイオセンサーを発現するトランスジェニックマウスの開発を進めており、 マクロとミクロと同時に分子活性を測定することで、 これまでに気付かなかった新たな生命現象の発見を目指します。