生きたマウスで組織・細胞形態を可視化
〜ひとつひとつの細胞の個性をみる〜
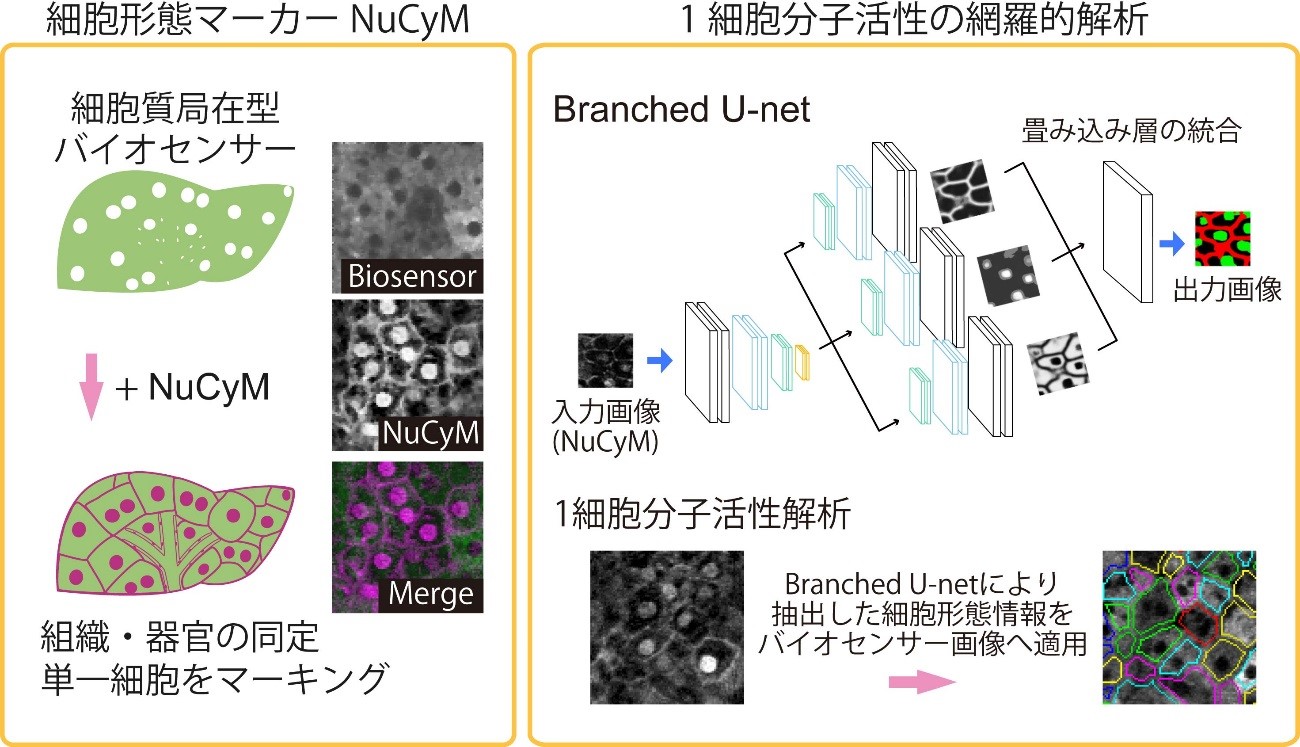
生体イメージングで組織の同定や細胞ごとの分子活性の解析を可能にするため、細胞形態を可視化できるマーカーNuCyMを開発し、 全身性にNuCyMを発現する遺伝子改変マウスを作出しました。また細胞ごとの分子活性を網羅的に解析するために、 教師つき機械学習Branched U-netを細胞形態情報抽出に用いた解析系を立ち上げました。 その結果、組織特異的な構造の同定や、生きたマウスの肝臓において個々の細胞の分子活性の網羅的解析に成功しました。 今回の成果により、生きたマウスの生体内FRETイメージングへの組織形態学情報の適用が可能になりました。 本研究成果は科学雑誌「Cell Structure and Function」に掲載されました (図1)。 (こちら)
図1: 細胞形態マーカーNuCyMを用いた1細胞分子活性解析
(左) NuCyMの適用により分子活性情報をもった個々の細胞の識別が可能となる。
(右) 機械学習Branched U-netによって自動抽出した個々の細胞領域をバイオセンサー画像に移すことで1細胞分子活性を解析できる。
研究の背景
私たちの研究室では、FRETの原理に基づくバイオセンサーを全身性に発現する遺伝子組み換えマウスを開発してきました。しかし、全身性に発現したバイオセンサーでは、細胞種や個々の細胞の識別が難しいという問題がありました。 本研究では、FRETバイオセンサーと同時に使用可能な細胞形態マーカーの開発を試み、 生きたマウスで分子活性と細胞形態の同時観察を行いました。
研究の内容と成果
まず細胞形態マーカーを開発し、全身で発現するマウスを作出しました。
このマウスは、ライブイメージングおよび透明化組織において特徴的な組織構造を同定可能であることを示しました (図2)。
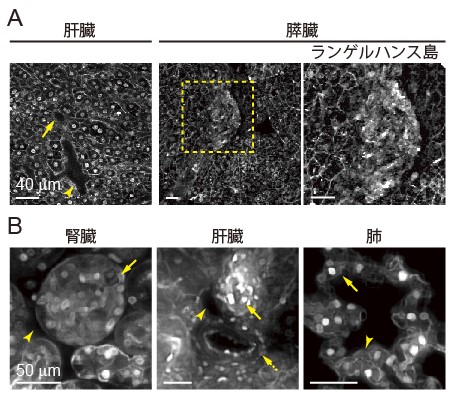
図2: 組織特異的構造の同定
(A) NuCyMマウスの肝臓と膵臓のライブイメージングを行った。
左: 肝臓において、門脈(矢印)および肝動脈(矢頭)を形態より同定した。
右: 膵臓において、ランゲルハンス島(中央; 黄枠内、右)を細胞密度より同定した。
(B) CUBIC試薬により透明化した組織のイメージングを行った。
左: 腎臓において、ボーマン嚢(矢頭)に包まれた腎糸球体を同定した。また、輸出入細動脈(矢印)も同定した。
中央: 肝臓において、静脈(矢頭)・胆管(矢印)・肝動脈(点線の矢印)により構成される門脈域を同定した。
右: 肺において、I型肺胞上皮細胞(矢頭)およびII型肺胞上皮細胞(矢印)を同定した。
個々の細胞の分子活性を解析するには、NuCyMにより得られる細胞形態情報から細胞の境界を抽出する必要があります。
この作業を自動で行うために、教師つき機械学習Branched U-netを適用しました。この方法を用いて、
NuCyMとERKバイオセンサーを共発現するマウスの肝臓における細胞ごとの分子活性を網羅的に解析しました。
その結果、MEK阻害剤への細胞ごとのERK活性の応答を網羅的に定量解析することに成功しました (図3)。
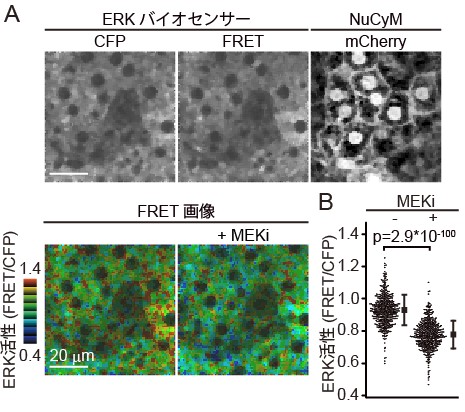
図3: 1細胞分子活性の網羅的解析
(A) ERKバイオセンサー(上段: 左、中央)とNuCyM(上段: 右)を共発現するマウスの肝臓のライブイメージングを行った。
ERKバイオセンサー画像から、MEK阻害剤添加前(下段: 左)と添加後(下段: 右)のFRET/CFP ratio画像を取得し
、MEK阻害剤添加後のERK活性の低下を確認した。
(B) 機械学習とフィルター処理により得た個々の細胞領域におけるERK活性を網羅的に解析した。
FRET画像の結果と一致して、MEK阻害剤処理後のERK活性の低下が確認された。
研究の意義
NuCyMによりマウス生体内における細胞形態情報の提供が可能になったことで、 これまで多く蓄積されてきた形態学・組織学の知識をライブイメージングに活かすことが可能になります。 また、従来の、興味のある細胞のみに焦点を当てて研究するのではなく、 ”組織中の全ての細胞を解析”することで、これまでに知られていなかった生命現象の発見が期待されます。
今後の展開
私たちはNuCyMとFRETバイオセンサーを共発現するマウスを用いて、 細胞種や細胞形態の変化が生体内分子活性にどのように関わっているかを解明することを目指します。