嵶朎廤抍偵傛傞攇僷僞乕儞宍惉偺怴棟榑傪敪昞
乣椡妛-惗壔妛憡屳嶌梡偵傛傞廤抍偺嫤挷揑側怳傞晳偄乣
奣梫
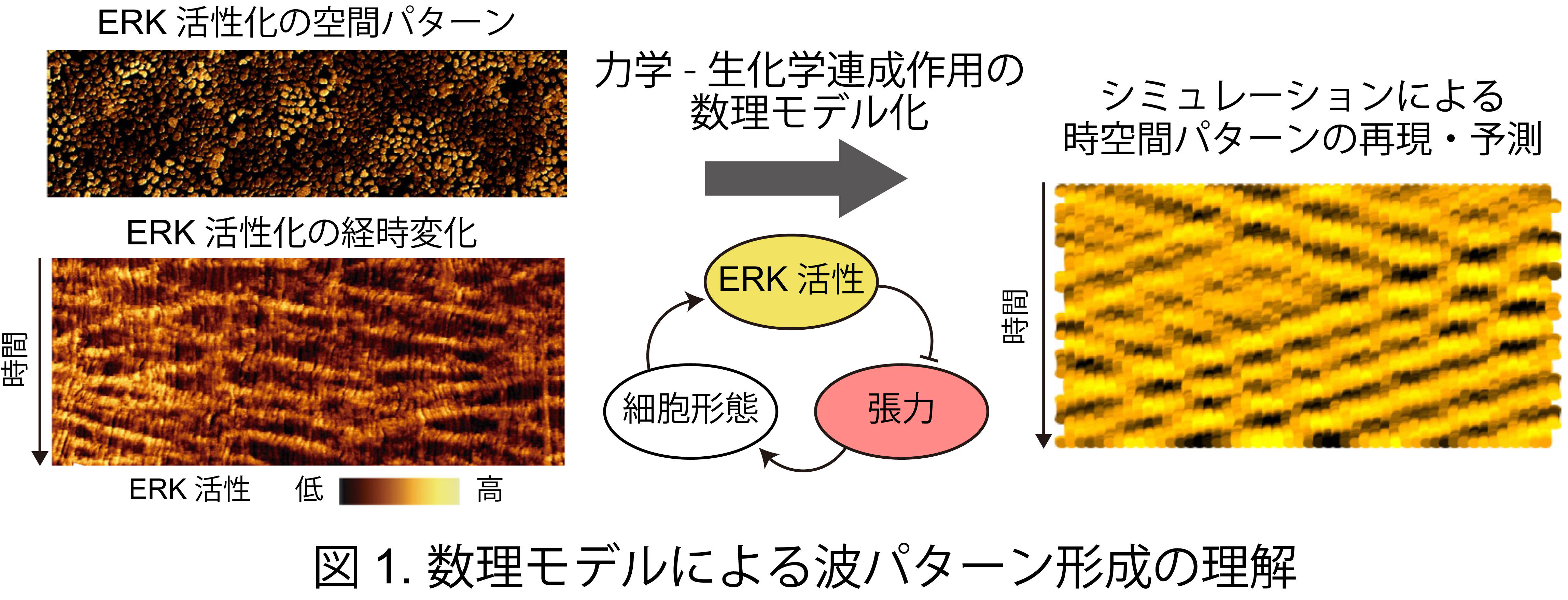
杮尋媶偱偼丄棟榑暔棟妛傪愱栧偲偡傞Edouard Hannezo攷巑傜偺僌儖乕僾偲嫟摨偱嵶朎廤抍塣摦帪偵尒傜傟傞嵶朎枾搙傗ERK MAP僉僫乕僛暘巕偺妶惈忬懺偑怐傝側偡攇忬偺帪嬻娫僷僞乕儞宍惉傪愢柧偡傞怴偟偄棟榑傪採彞偟傑偟偨丅嵶朎廤抍偑憂傝弌偡帪嬻娫僷僞乕儞偼惗柦壢妛偺傒側傜偢旕暯峵暔棟妛側偳偺懠暘栰偱傕峀偔娭怱傪廤傔偰偄傑偡丅偟偐偟丄僷僞乕儞宍惉偵偍偗傞嵶朎偺椡妛偲嵶朎撪偺惗壔妛斀墳偲偺摑崌揑丒掕検揑棟夝偼晄廫暘偱偟偨丅杮尋媶偱偼嵶朎偑惗傒弌偡婡夿揑側椡傗暘巕妶惈偺應掕丒憖嶌媄弍傪梡偄偰掕検揑側僨乕僞傪庢摼偟丄偙傟傪傕偲偵嵶朎廤抍偱娤嶡偝傟傞僷僞乕儞宍惉偺悢棟儌僨儖傪峔抸偟傑偟偨 (恾1)丅悢棟夝愅偵傛傝丄攇偺傛偆側帪嬻娫僷僞乕儞偑惗偠傞忦審傗僷僞乕儞偺帪嬻娫僗働乕儖傪摿挜偯偗傞検傪摫弌偟傑偟偨丅偝傜偵丄幚嵺偺嵶朎廤抍偱娤嶡偝傟傞暘巕妶惈偺帪嬻娫僷僞乕儞偑丄嵶朎廤抍塣摦偺懀恑偵嵟揔壔偝傟偰偄傞偙偲傪棟榑揑偵採彞偟傑偟偨丅杮惉壥偼丄嵶朎偵尷傜偢擻摦揑偵塣摦偡傞巇妡偗傪帩偮暔懱廤抍偺暋嶨棳懱尰徾偺棟夝偵婑梌偡傞偙偲偑婜懸偝傟傑偡丅杮惉壥偼丄2020擭俋寧29擔偵塸崙偺崙嵺妛弍帍乽Nature Physics乿偵僆儞儔僀儞宖嵹偝傟傑偟偨丅
尋媶偺攚宨
庴惛棏偑暘楐傪孞傝曉偟偰暋嶨側憻婍傪帩偮屄懱偵側傞丄夦変傪偟偨屻偵尦偺忬懺偵帯桙偡傞丄偲偄偭偨巹偨偪偺懱偺拞偱婲偒傞條乆側惗柦尰徾偵偼丄嵶朎廤抍偺嫤挷揑側怳傞晳偄偑昁梫偱偡丅埲慜巹偨偪偼丄忋旂嵶朎偺憂彎帯桙夁掱偵偍偄偰丄條乆側嵶朎婡擻傪惂屼偡傞亀嵶朎奜僔僌僫儖挷愡僉僫乕僛乮Extracellular signal-regulated kinase丄埲壓ERK偲棯偟傑偡乯亁偺妶惈偑嵶朎摨巑偺堷偭挘傝崌偄傪夘偟偰嵶朎娫傪揱攄偟丄攇偺傛偆側僷僞乕儞傪宍惉偡傞偙偲偱嵶朎廤抍偱偺嫤挷揑側塣摦偑幚尰偝傟傞偙偲傪柧傜偐偵偟傑偟偨乮Hino et al., Developmental Cell, 2020; 摦夋1乯丅偟偐偟丄偦偺攇僷僞乕儞宍惉偺掕検揑丒棟榑揑側棟夝偼晄廫暘偱偟偨丅偦偙偱巹偨偪偼丄嵶朎摨巑偺堷偭挘傝崌偄側偳偺椡妛偲ERK僔僌僫儖宱楬傪婎幉偲偡傞惗壔妛斀墳偺楢惉僔僗僥儉偵徟揰傪摉偰丄嫤挷揑側廤抍塣摦傪惗傒弌偡惂屼僔僗僥儉傪嵞尰丒梊應偡傞悢棟儌僨儖偺憂弌偵庢傝慻傒傑偟偨丅杮僾儘僕僃僋僩偱偼丄嫗搒戝妛SPIRITS偺巟墖傪庴偗乮僾儘僕僃僋僩柤丗嵶朎廤抍塣摦偺摑崌揑棟夝偵岦偗偨儊僇僲僶僀僆儘僕乕尋媶偺崙嵺嫟摨僱僢僩儚乕僋峔抸乯丄棟榑暔棟妛傪愱栧偲偡傞Edouard Hannezo攷巑傜偺僌儖乕僾乮Institute of Science and Technology Austria丄僆乕僗僩儕傾乯偲嫤摥偟丄尋媶傪恑傔傑偟偨丅
尋媶庤朄丒惉壥
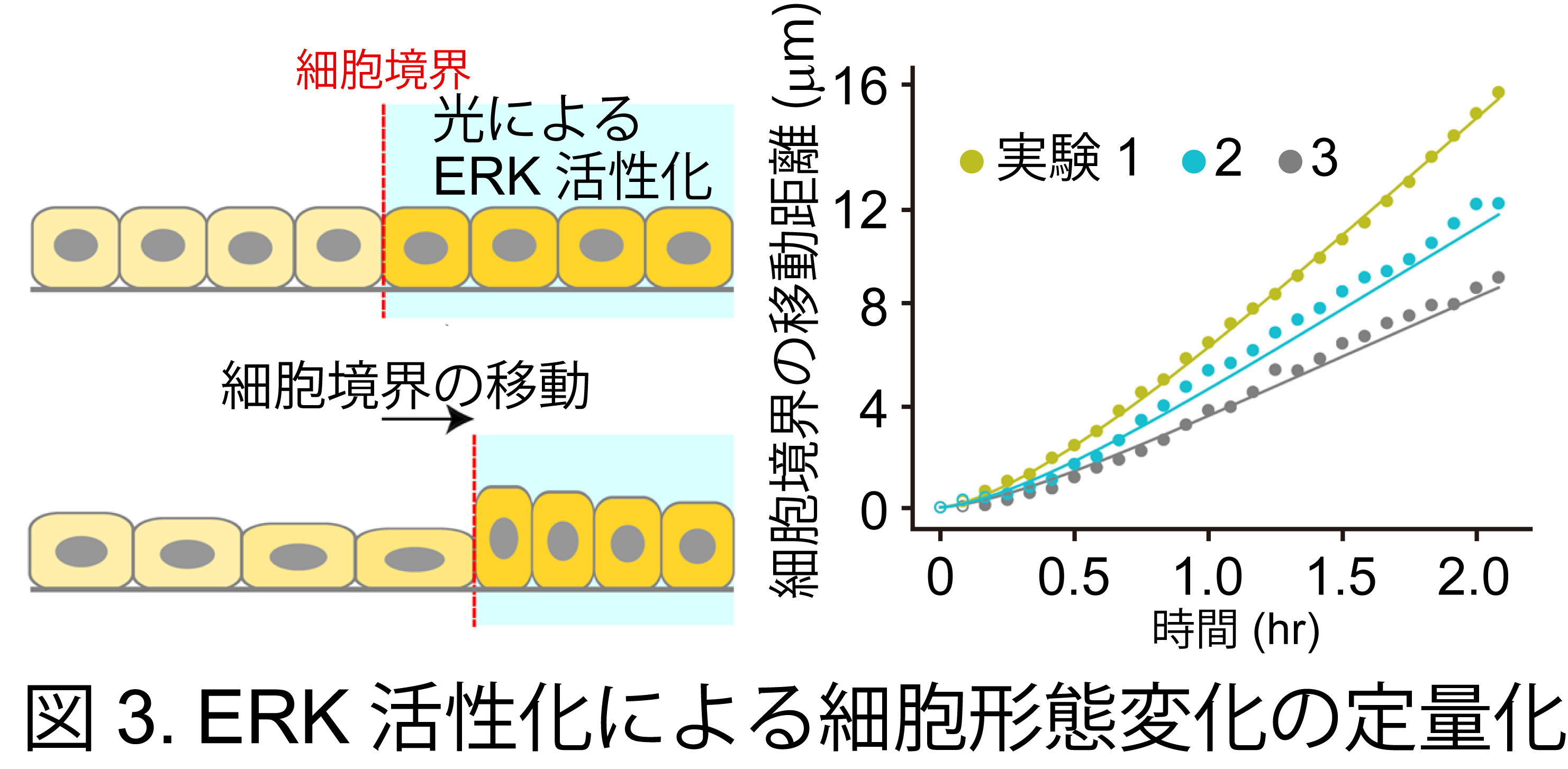
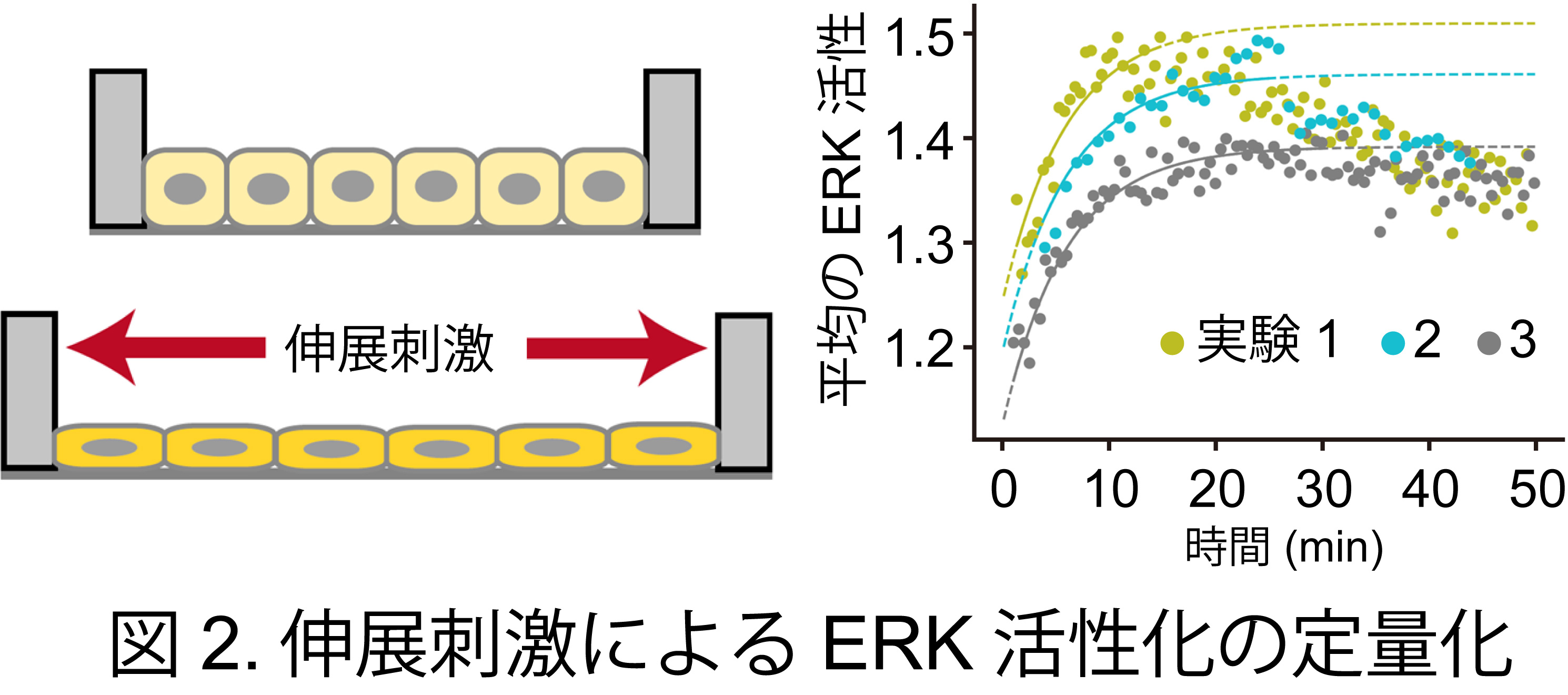
杮尋媶偱偼丄嵶朎撪偺ERK妶惈傪壜帇壔偡傞偙偲偺偱偒傞僶僀僆僙儞僒乕傗ERK妶惈傪憖嶌偱偒傞岝堚揱妛媄弍傪梡偄偰丄嵶朎廤抍塣摦帪偺嵶朎宍懺傗椡丄ERK妶惈側偳暋悢検傪應掕丒憖嶌偟丄偦傟傜偺憡娭傪掕検揑偵夝愅偟傑偟偨丅摿偵丄嘆嵶朎偵怢揥巋寖傪晧壸偟偨応崌偺ERK妶惈摦懺 (恾2)丄嘇岝堚揱妛媄弍傪梡偄偰ERK傪妶惈壔偝偣偨応崌偺嵶朎宍懺曄壔 (恾3)丄嘊嵶朎偑婎幙偵懳偟偰嶌梡偝偣傞婡夿揑側椡偺掕検僨乕僞傪摼傑偟偨丅摼傜傟偨幚尡寢壥傪傕偲偵悢棟儌僨儖傪峔抸偟丄悢棟夝愅傪捠偟偰ERK妶惈偺暋嶨側帪嬻娫僷僞乕儞傪摿挜偯偗傞検傪摫弌偟傑偟偨丅傑偨丄掕検僨乕僞傪梡偄偰悢棟儌僨儖偺僷儔儊乕僞乕傪嶼弌偟丄偙偺僷儔儊乕僞傪梡偄傞偙偲偱嵶朎枾搙傗ERK暘巕妶惈偺帪嬻娫僷僞乕儞傪僐儞僺儏乕僞忋偱嵞尰偡傞偙偲偵惉岟偟傑偟偨 (恾1)丅偝傜偵丄幚嵺偺嵶朎廤抍偱娤嶡偝傟傞暘巕妶惈偺帪嬻娫僷僞乕儞偑丄廤抍嵶朎塣摦偺懀恑偵嵟揔壔偝傟偰偄傞偙偲傪棟榑揑偵採彞偟傑偟偨丅杮尋媶惉壥偼丄椡妛亅惗壔妛偺楢惉嶌梡傪拞怱偵悩偊偨怴偨側懡嵶朎摦懺儊僇僲僶僀僆儘僕乕尋媶偺婎斦偲側傞偙偲偑婜懸偝傟傑偡丅
崱屻偺揥奐
擻摦揑偵塣摦偡傞暔懱乮傾僋僥傿僽儅僞乕乯偑孮傪側偟偰惗傒弌偡嫤摨尰徾偼丄暘巕偐傜僸僩傪娷傓摦暔屄懱偵帄傞條乆側僗働乕儖偱娤嶡偝傟丄惗暔妛偺傒側傜偢暔棟妛傗壔妛側偳偺娤揰偐傜傕惙傫偵尋媶偑恑傔傜傟偰偄傑偡丅杮尋媶偼嵶朎廤抍偑惗傒弌偡朙偐側僟僀僫儈僋僗偲偦偺尨棟傪帵偟偨傕偺偱偁傝丄懠暘栰偺婎慴揑側栤戣偺夝寛偵偮側偑傞偙偲偑婜懸偝傟傑偡丅 傑偨丄ERK妶惈偼憻婍偺偐偨偪嶌傝傗庮釃宍惉丄憂彎帯桙側偳堛椕偵傕怺偔娭梌偡傞廳梫側僞儞僷僋幙偱偡丅崱屻丄椡妛亅惗壔妛楢惉偵婎偯偔懡嵶朎偺嫤摨尰徾偺夝柧傪恑傔傞偙偲偱丄幘姵偺棟夝傗怴偨側帯椕朄偺奐敪偵栶棫偮婎慴抦尒傪愊傒忋偘傞梊掕偱偡丅
尋媶僾儘僕僃僋僩偵偮偄偰
擔杮妛弍怳嫽夛 壢妛尋媶旓乮17J02107乯丄壢妛媄弍怳嫽婡峔乮PRESTO JPMJPR1949乯丄嫗搒戝妛SPIRITS 2018丄僆乕僗僩儕傾壢妛婎嬥乮P31639乯丄墷廈尋媶夛媍乮851288乯傜偺巟墖傪庴偗偰幚巤偝傟傑偟偨丅Institute of Science and Technology Austria (IST Austria丄僆乕僗僩儕傾)偲偺嫟摨尋媶偱偡丅