腸管神経細胞における情報伝達分子の意義の解明
〜胎児の腸壁を動く神経細胞で分子活性を初めて可視化〜
|
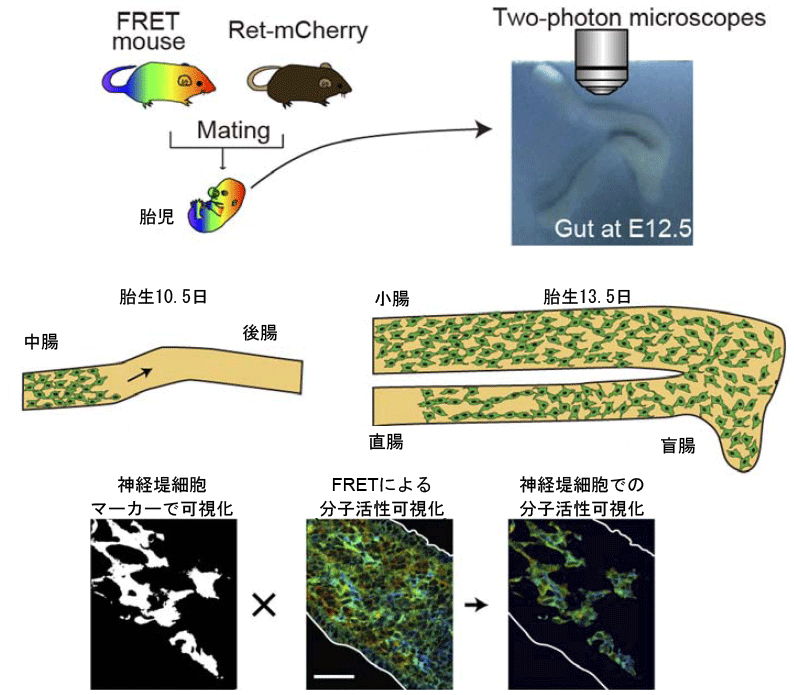
私たちの腸管は蠕動と呼ばれる動きによって食物を動かしています。この蠕動運動を司るのは副交感神経系に属する筋間神経節あるいは粘膜下神経節の神経細胞です。これらの神経細胞は神経堤細胞に由来し、発生時には腸管神経堤由来細胞(Enteric neural crest-derived cells, ENCCs)と呼ばれていて、が胃から直腸へ向かって神経ネットワークを形成しながら下降し、それぞれの場所で定着して神経節を形成していきます。そして、直腸に到達すると運動を停止して、完全な腸管神経ネットワークを形成します。このネットワークが正常に働くことで蠕動運動が起きるのです。この腸管神経堤由来細胞の運動の異常をきたす先天疾患は、Hirschsprung病をはじめいくつか知られており、腸管運動不全を起こします。これまでグリア由来神経成長因子(GDNF)とエンドセリンが、セリンスレオニンリン酸化酵素であるERKおよびPKAおよびRac1低分子量GTP結合タンパク質を介してこの腸管神経堤由来細胞の運動を制御しているとされていましたが、これらの分子活性の変化を実際に観察した人はいませんでした。 わたしたちは、PKA、ERK、Rac1の活性を測定するFRETバイオセンサーを発現するトランスジェニックマウスを用いて、腸管神経細胞発生過程におけるこれらの分子の時空間制御機構および意義を研究しました。 その結果、腸管神経堤由来細胞の運動とERKおよびRac1活性は非常によく相関すること、一方、PKAは腸管神経堤由来細胞の運動とほぼ逆相関することがわかりました。 すなわち、腸管神経堤由来細胞の発生過程において、ERKがアクセルを、PKAがブレーキの役割を担っており、これらがRac1を介したアクチン骨格の制御を通して腸管神経堤由来細胞の分布を決定していることがわかりました。 本研究成果は科学雑誌「Journal of Neuroscience」に掲載されました(こちら)。 |
|