FLIMのやり方
目次仕様とメモ
- Olympus FV1000-MP, IX83
- Spectra Physics Mai Tai DeepSee
- Becker & Hickl GmbH SPC-150/DCC-100/SPC Image
-
Mai-Tai DeepSeeの仕様
- 80 MHz. つまり、12.5 nsに1回発振する。蛍光寿命はこの時間内に測定し終える必要がある。蛍光タンパク質は3 nsくらい。有機蛍光色素は1ns>。
- Pulse 幅 = 70 fs。蛍光寿命と比較して十分短い。
- Defaultでは、12 ns解析している。Matrixは256である(T1, T2の時間)。
Mai-tai DeepSeeの立ち上げ方
- DELL notebook PCを起動する。
- 「com port1」を選択 「scan」「setup」は使用しない。
- 「shutter」が閉じていることを確認。
- 「ON/OFF」ボタンを「EMISSION」が点灯するまで長押ししてレーザーを発振させる。5分くらいかかる。
- 「shutter」を開く。長押し。
目次へ
FV1000での観察
- 集合電源のMain Switch ON。
- HgランプON。
- PC ON
- FV10-ASW 起動
- 顕微鏡右側面のキューブチェンジャーのシャッターを開ける(普段は開いているはずだが。手動)
- 透過光で観察、ついで蛍光観察
- 蛍光キューブはIX83のパネルからNIBAを選択。青い光。赤は右のボタン。
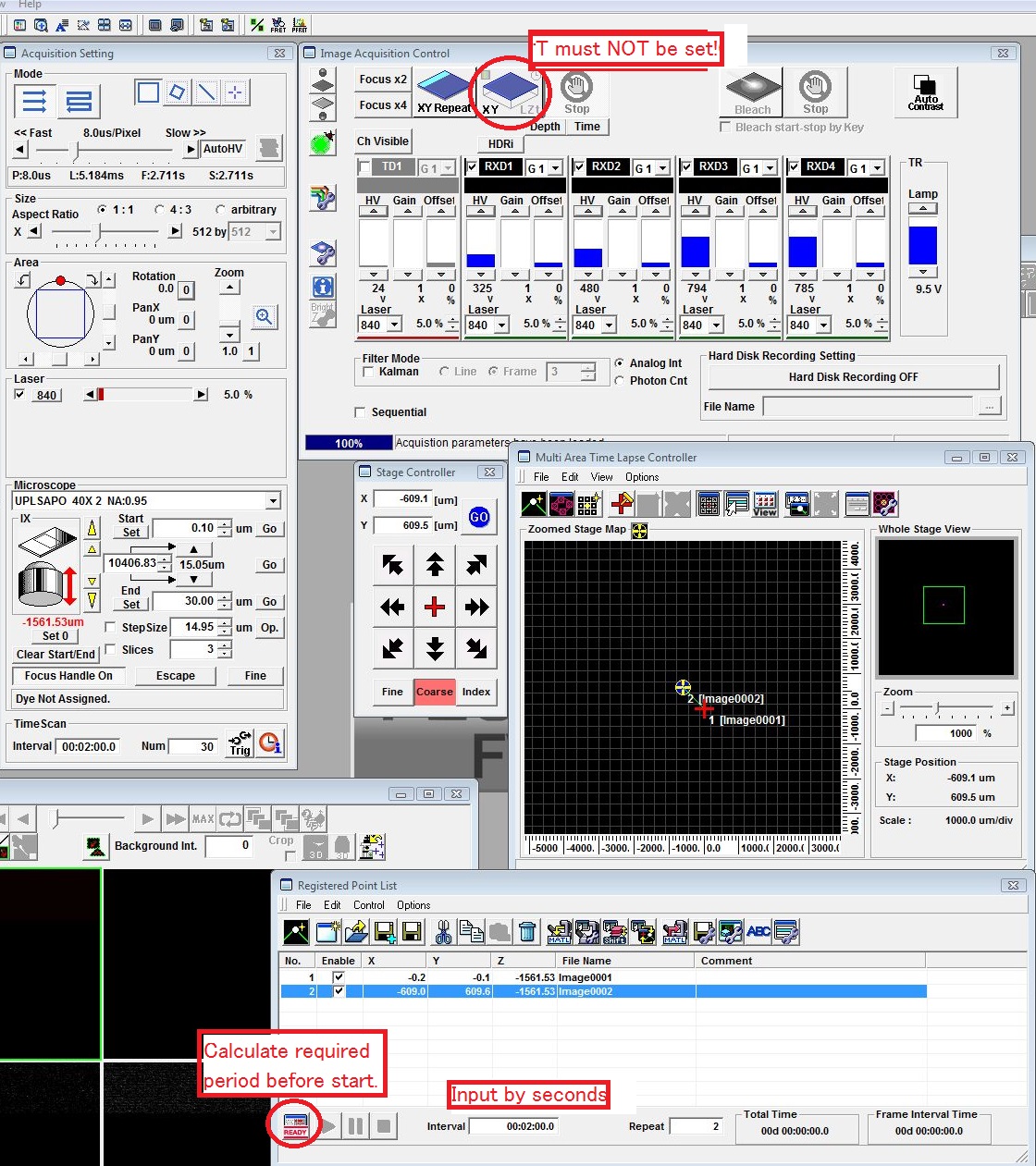
- 画像の二光子観察:感度の設定。これが大事
- 画像の二光子観察:タイムラプスやるときの設定(FLIMでは使わない)。
- 画像の二光子観察:512*512で観察のこと。
- Zoomをかけてみたい領域だけScanするようにする。
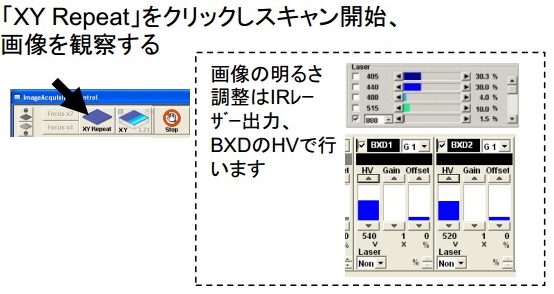
目次へ
FLIMでの観察の要注意事項

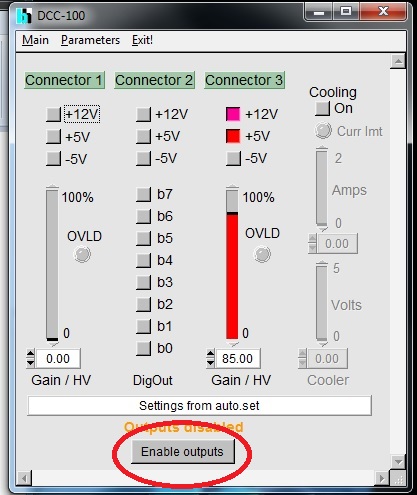
- シャッターは2か所:顕微鏡右横のレバー(手動)とDCC-100のシャッター(Enableで開く)
- レバーで光路を検出器に変更するときは、室内灯は消すこと。
- DCC-100(検出器)をEnableする前に、カーテンを閉めること。
- 実験中に顕微鏡の接眼レンズで目視するときが特に危ない。必ず右横のレバーが押し込まれているか確認のこと。
目次へ
FLIM起動:電源を入れる順番は重要
- Simple_Tau (extension box)のMain Switch ON。写真の前面にスイッチ。後面に主電源スイッチがある。主電源スイッチはずっといれたままでいい。
- NotePCの電源を入れる。
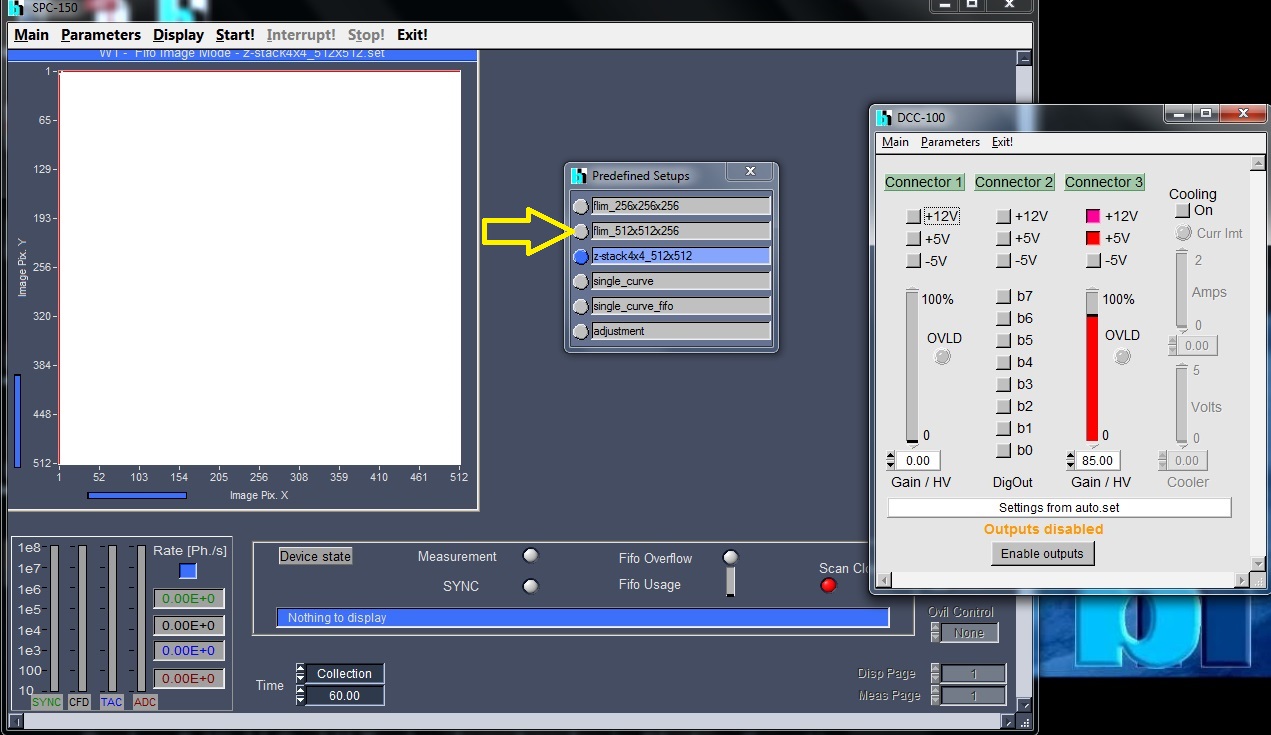
- SPCM64を起動: SPC-150とDCC-100の二つのWindowが起動する。DCC-100はSPC-150の後ろにあるので見えないことがある。
- 電源を入れる順番を間違えると、SPCM64がsimulation modeで起動するので注意。
- Predefined setupから、512*512*256を選択。
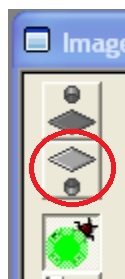
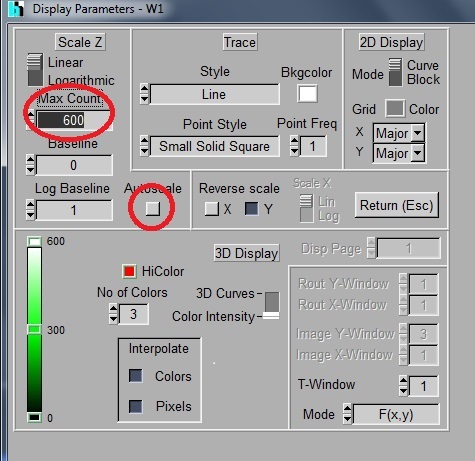
- SPC-150: 画像を右クリック -> Display Parameters -> Autoscale, OFF; MAX Count, 600; HiColor, Red
- Lifetimeの測定には6000 photonが必要。通常、Binning 1 (9 pixels)をかけるので、600くらいでOK。測定したいところが赤くなったら終了。
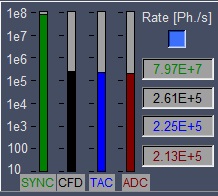
- この時点では、SYNCのみ数字が出ている。画像もまだでていない。
- DCC-100のwindowに移って、Enable Outputs(シャッターを開く)
- SYNC以外の数字(/sec)が動き始める。
- SYNC: Laserの周期, 80 MHz -> 12.5 nsおきに発振。
- CFD, constant fraction discriminators: 検出された光子の数
- TAC, Time-to-Amplitude Converter: Amplitudeに転換された電子数
- ADC, Analogue to Digital Converter : デジタル転換された電子数
- 観察中にCFDが減少すればPhotobleachingしているということ。
- 動作確認ができたら、いったん、DCC-100をDisableする。
- FV10-ASW: Scan開始し、観察する細胞を中心に持ってきて、Focusを合わせる。いったんScan停止。
- IX83: 右側面のレバー(図の黄色)を引っ張る(光路切り替え)
- カーテンを閉じる。
- DCC-100: Enable(シャッターを開く)
- FV10-ASW: Laser Scan開始。
- SPC-150: CFD, TAC, ADCが増加するはず。
- SPC-150: START!
- FV10-ASW: Laser PowerをCFDが5*10^4 - 5*10^6になるように調整。
- SPC-150: 見るべき細胞が規定値を超えたら(赤くなる)STOP!
- FV10-ASW: Scan停止
- SPC-150: Save the FLIM data; Main -> Save ZドライブがDOCKなのでここに保存してください。
- このまま解析するか、ほかの細胞の観察を続ける。
- SPC-150: Main->Exit
- Windows 終了。
- DCC-100の電源を切る。/li>
- FV10-ASWを終了する。
- 「shutter」を閉じる。
- 「ON/OFF」ボタンを押し、レーザー発振を止める。
- 「QUIT」を押す
- Windowsを終了する。
- このプログラムの仕事: Lifetimeをモデルに当てはめて計算する。
- 開始: File(*.sdt) -> Import
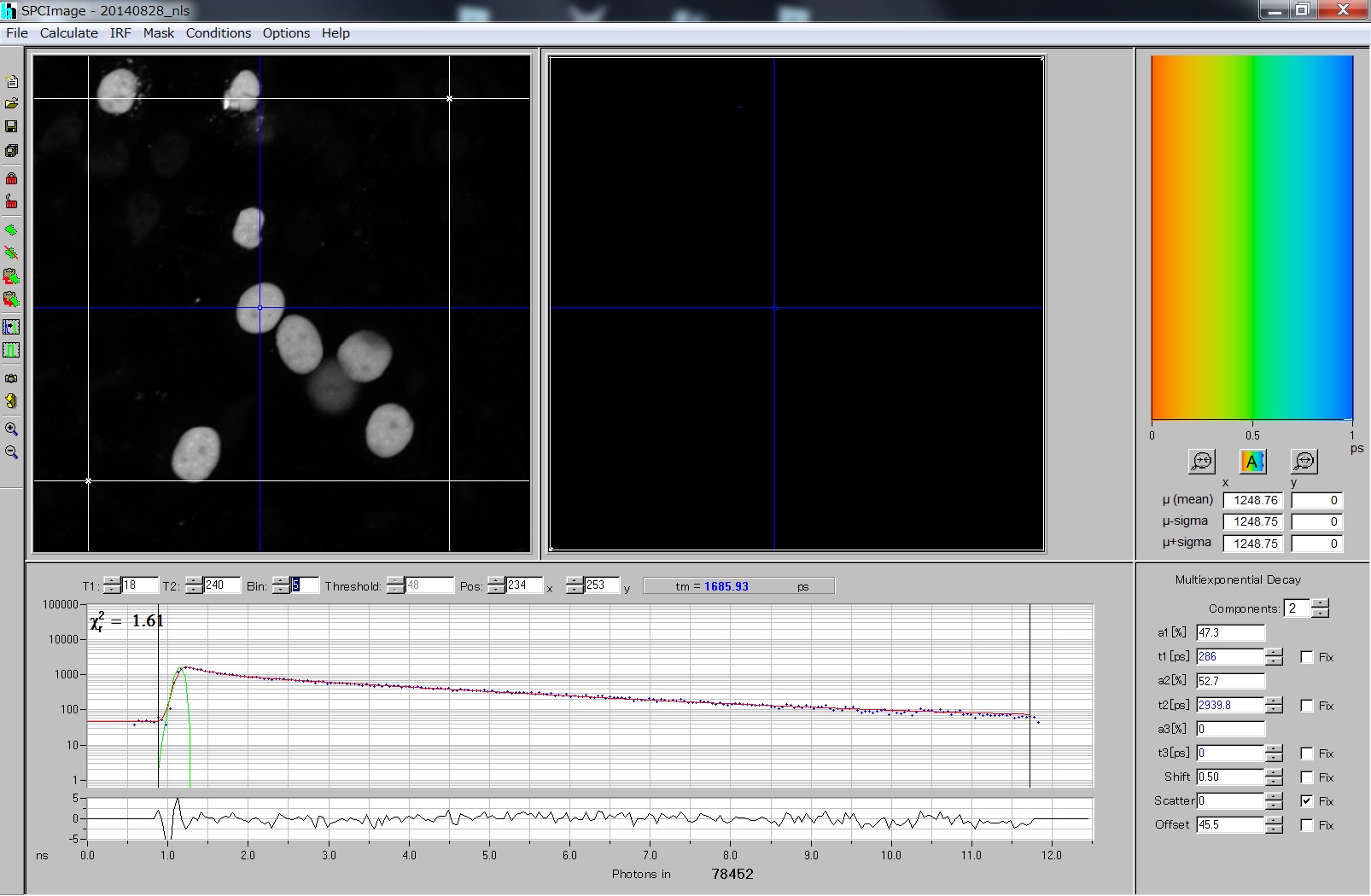
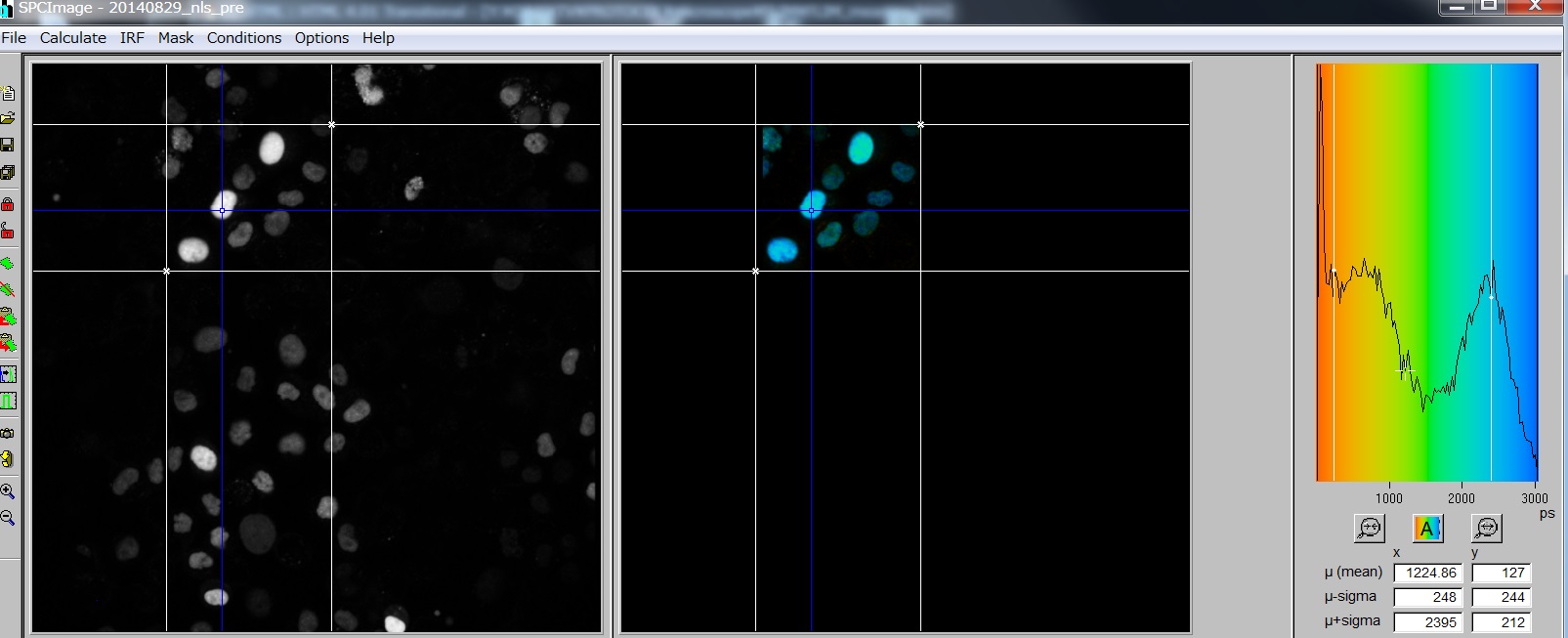
- 左画面、生データ;右画面、Calculateした結果がでるところ
- Blue crosshair:は最初に一番Intensityの高いところにでるが動かせる。この点のDecayが下図に出てくる。
- コマンドラインの用語解説
- Calculate : 指定した領域のDecay matrixを計算し、絵とヒストグラムを右画面にだす。
- IRF(instrumental response function): 検出器の時間分解能を示す関数。緑のライン。その都度計算もできるし、あらかじめ実験で決めておいてもいい。
- Mask 領域を任意に指定できる。
- 右下画面の用語解説
- component: 蛍光寿命がいくつあるとしてFitするか。Lifetimeに大きく影響するので解析中は一定にすること。
- Photon count(2つの蛍光寿命の場合): N(t) = a1*e-t/τ1 + a2*e-t/τ2 (a1 + a2 = 1)
- a1, ある蛍光寿命をもつ分子の割合;τ1, 蛍光の時定数
- Shift: IRFと蛍光のずれ(緑線のピーク)
- Scatter: 散乱光および二次高調波の漏れこみ(一番最初のピークにのみ影響する)
- Offset: 室内光などの漏れこみ。
- a1/a2: それぞれの蛍光寿命をもつ分子数の比。厳密なFRET効率を示す。
- tm: 平均の蛍光時定数(寿命)、FRETのレベルを示す。
- Decay matrix(右図)
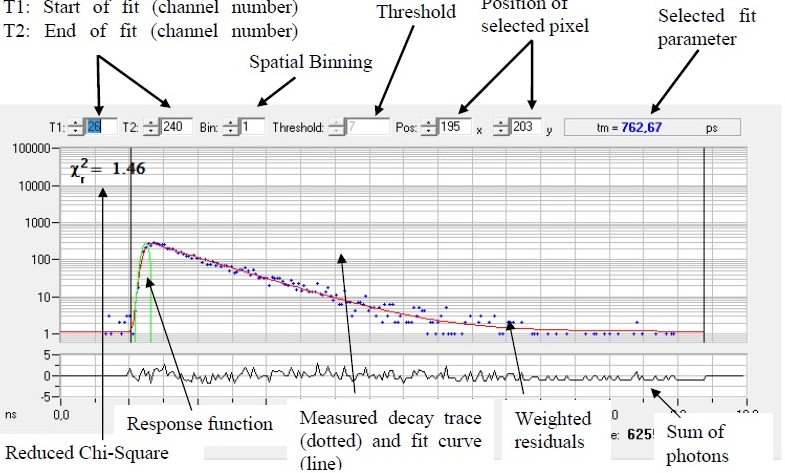
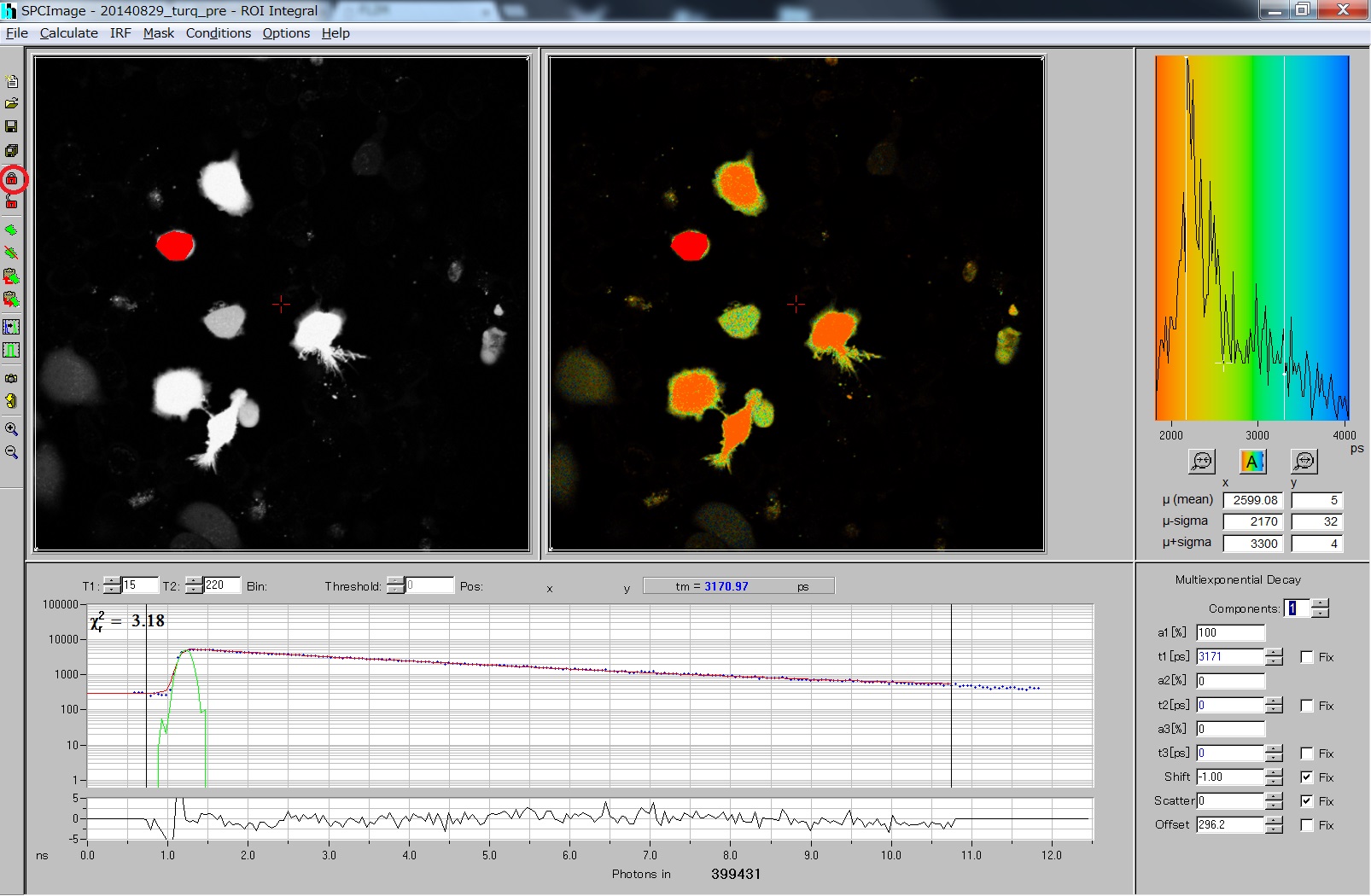
- T1-T2 の間(黒線で出てる)を解析: ここをよい値に設定することが大事。χ2の値を参考にしながら変える。数字は256チャンネルの値。
- Bin, Binning。MetaMorphと違う。0=1 pixel, 1=3x3, 2=5x5, --
- この値は、どれくらいのPhoton count(一番下の数字)が解析に必要かを考えて決める。目安=蛍光分子1個、100; 二つ、1000; 三つ、10000。 蛍光寿命が既知であればFixできるので、ずっと少なくできる。
- χ2: χ2検定による尤度。 現在のモデルの信頼性を各ピクセルごとに表示している。この値をできるだけ小さくするようにモデルを決める。
- Threshold, 計算をするPixelの最低のPhoton数。計算時間を早くする。普通はautoになってる。替えたければ、Options > Model dialog in section
- 解析法: ある領域で解析
- 左画面で白線を動かして(隅の交点がハンドル)、解析する領域を設定する。
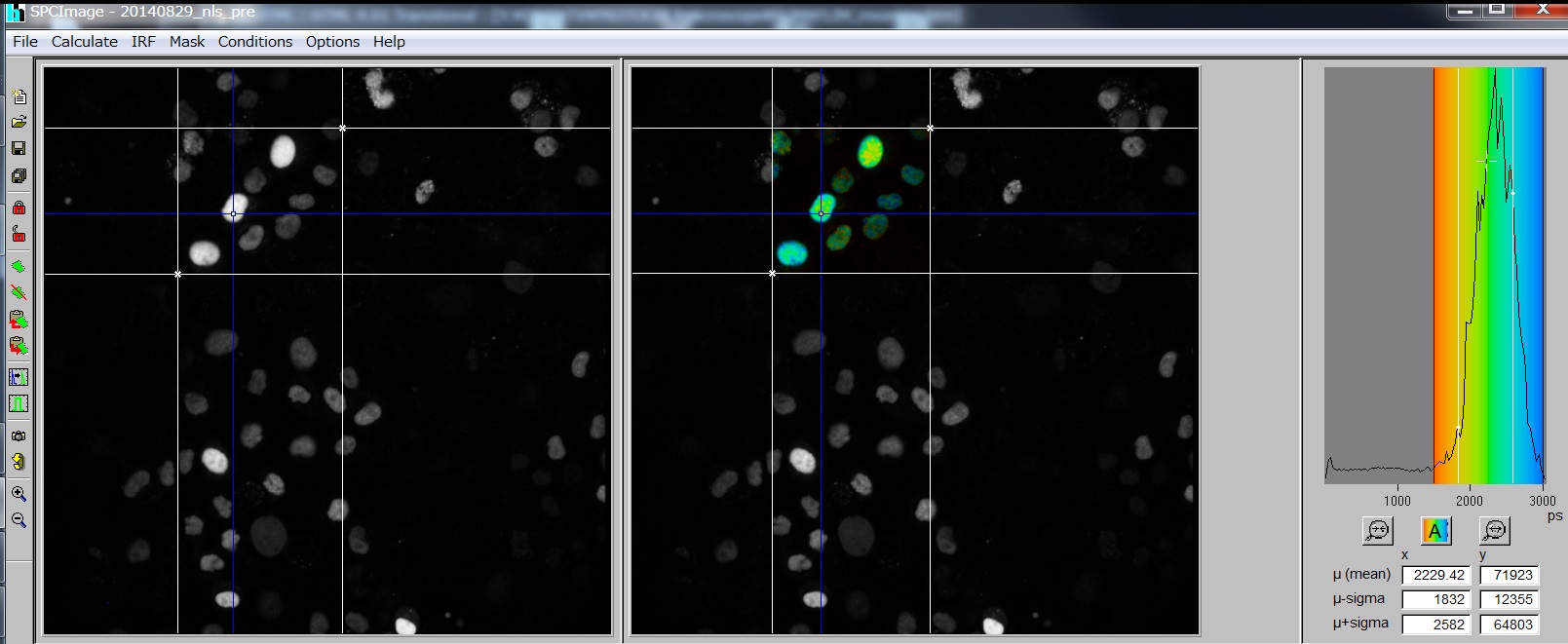
- Calculate -> Decay Matrix: 右にIntensity-modulated のLifetime画像がでる。
- 色が出ないとき: Option -> Color -> Continuous -> Min, Maxの数字を変える。
- 一番右のグラフは、その分布; μとSigmaは図中のプラスと白線。ピクセルごとの値なので、サンプルがないピクセルが多いと意味がない。
- ヒストグラムを強度ごとに転換する: Options -> Preferences -> Histogram -> Pixel Intensity
- Options>Prefrences: Show Intensity in Lifetime Window 設定領域以外ではintensityが見える。
- カラーレンジは、端の線をマニュアルで動かすか、または数字を入力する;Options -> Color -> Max, Mini
- 解析法: 特定の細胞で解析
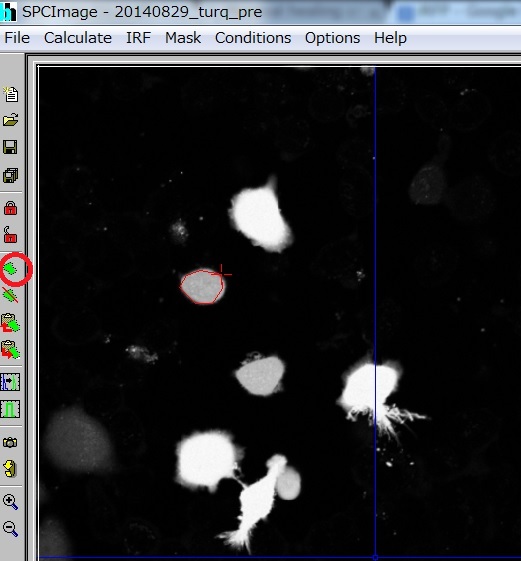
- Mask -> Define (あるいは左画面の緑のアイコン)から赤十字を出す。ドラッグして細胞を囲む
- Mask -> Undefine (あるいは左画面の緑と赤線のアイコン)で消去できる。
- 左の赤い錠のアイコンをおすと、その細胞のDecayが下のグラフにでる。
- χ2の値が最小になるように、T2の時間と、Componentの数を変化させる。 このTurquoiseの場合、Componentを二つにしても、3000以外の蛍光寿命は出てこない。しかし、T2の時間を短くすると二つになるので注意が必要。
- 詳細は、SPCImage manual 27 page参照
- 画面の切り替え: Options -> Color -> Coding of tm [ps](平均蛍光寿命) ほかにもいろいろある。
- 画像の出力:
- Defaultでは画面をコピーするだけなので次の設定をOFFにすること。Options -> Intensity -> Other -> Interpolate pixels。 ただし、これをやると、画面の更新が遅くなるらしい。気になる場合は、Exportのつど、Interpolate OFFにする。
- ノートに貼る程度の写真なら、アクセサリー→Snipping Tool→画像を囲む →コピ→Excelにペースト。解析手法もはいるのでこの方がベター。
- File -> Export -> Color coded image, ON; with legend, ON; Format, TIF
- Legend をONにすると、MetaMorphで開けなくなる。この場合、Legendだけ別に出力する。
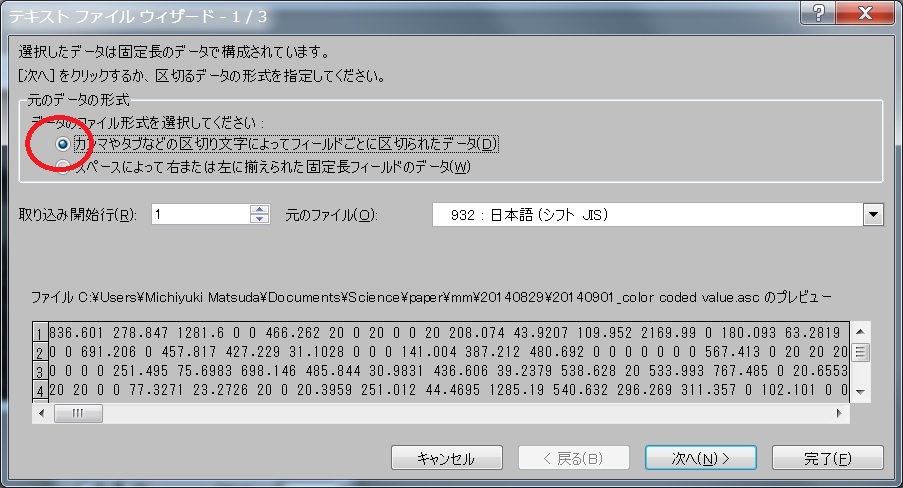
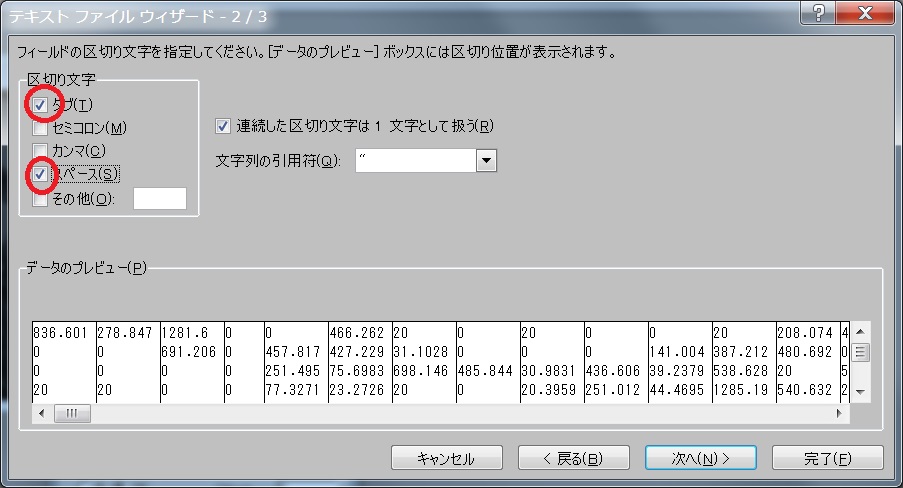
- File -> Export -> Matrix -> Color Coded Valueとすると、Calculateした領域のlifetimeのデータがAscフォーマットででてくる。 Excelで見るなら、スペースとコンマを区切り文字に指定すればよい。 しかし、画像化することを考えればMATLABに出力すべきでしょう。MetaMorphで解析する方法は次項参照。
- SPCImageで解析する領域を選択
- 上記のように条件検討ののち、Calculate -> Decay Matrix
- File -> Export -> Matrix; Color Coded Value, Pixel Intensities; Image, Color Coded Image, TIF; 。 Excel
- "**_color coded value.asc" というファイルを開いて、データサイズを確認。これが面倒なら、領域を指定せずにCalculateして、512x512とするという手もあるかも。
- File -> Open Special -> Import -> File Type, Text; Depth, 16; Width, Height 入力(Excelの列数と行数)
- **_color coded value.asc. Pixelごとのlifetimeなどを計算できる。
- **_photons.asc, intensity. PixelごとのPhoton Count (強度)。
- 後者でマスクを作って解析するといい。
- DCC-100 does not start up. This may disturb synchronization. Check DCC-100 detector control.
- SYNCがでない: 光がDCC-100まで来ていない ---> 700 nmではsynchroしないみたいだ

目次へ
FLIM観察

SPCの終了
Mai Tai DeepSEEのShutOFF
目次へ
FLIM解析: SPCImage
MetaMorphでの解析
-
SPCImage
MetaMorph
Trouble shooting