参考文献
K. Terai and M. Matsuda. Ras binding opens c-Raf to expose the docking site for MEK. EMBO Rep. 6:251-255, 2005.
Rafの活性化のメカニズムには2つの説があり、1つはRafが細胞膜上へ局在変化し、リン酸化されることで必要十分という説、もう一つは、リン酸化に加えRasによるRafの構造変化が必要という説である。しかしながら、Rafの構造変化に関しては、多くの論文のDiscussionで書かれることがあるが、実際に観察する事は難しく、推測されているのみである。そこでFRETを用いてRaf分子の構造変化を検出し、Rafのリン酸化、酵素活性、他分子との相互作用などの生化学的手法に加え、過去に調べることができなかった構造変化の観点より、その活性化の機序を解析した。
研究成果
1.c-Raf-1の構造変化をモニターする分子の作製
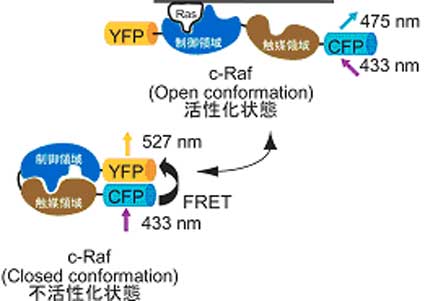
N末より緑色蛍光蛋白(GFP)の黄色変異体であるYFP、全長のRaf、シアン色変異体のCFPを直列に連結したキメラタンパク質を作製した。RafはN末に制御領域、C末に触媒領域を持つことが知られていたので、不活化状態で折りたたまれ、活性化すると開くようにデザインした。つまり、不活化状態ではCFPとYFPが近傍にあるために、蛍光共鳴エネルギー移動(FRET)が起こり、CFPが光らずにYFP由来の蛍光が、活性状態ではCFPとYFPの距離が離れるためにCFP由来の蛍光が観察される。
2.増殖因子刺激時におけるc-Raf-1の構造変化と局在変化
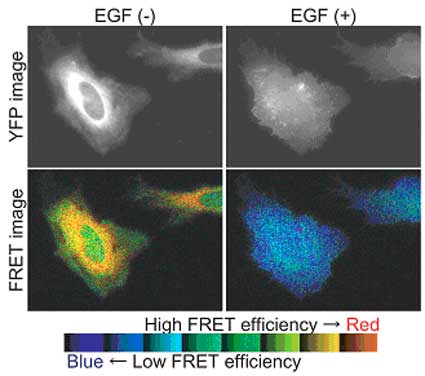
増殖因子刺激後、プローブは細胞質から細胞膜上に局在移行し、同時にRafの構造変化が起こることが観察された。この結果よりRafは細胞膜上でのみ構造変化している事が明らかになった。
3.c-Raf-1の構造変化がシグナル伝達に与える影響
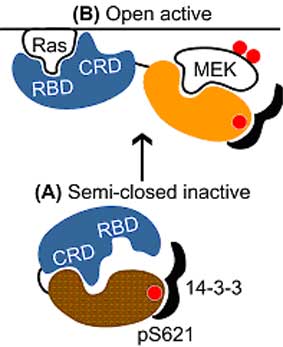
RasによるRafの構造変化はMEKと結合するために必要ではないかと考え、RafとMEKのそれぞれにCFP、YFPを融合させ、分子間のFRET効率を測定した。その結果、Rafの構造変化はMEKとの結合能に相関し、MEKのリン酸化に必要であることを明らかにした。